题目内容
9.为清理路面积雪人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54mol电子.该融雪剂的化学式是CaCl2,该物质中化学键类型是离子键,电子式是
 .
.
分析 融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca、Y为Cl,以此来解答.
解答 解:融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为$\frac{54}{3}$=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca、Y为Cl,CaCl2中只含离子键,其电子式为 ,
,
故答案为:CaCl2;离子键; .
.
点评 本题考查位置、结构、性质的综合应用,为高频考点,把握元素的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及周期律的应用,题目难度不大.

练习册系列答案
相关题目
19.以下说法不正确的是( )
| A. | 绿色食品是指不含任何化学物质的食品 | |
| B. | 硅是制造太阳能电池的常用材料 | |
| C. | NaOH溶液可以盛装在带橡皮塞的试剂瓶中 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
17.质量数为A,核内中子数为N的R2+离子与16O所形成的Wg氧化物中所含质子的物质的量为( )
| A. | $\frac{W}{A+16}$(A-N+8)mol | B. | $\frac{W}{A+16}$(A-N+10)mol | C. | (A-N+8)mol | D. | $\frac{W}{A}$(A-N+6)mol |
14.下列说法正确的是( )
| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 配制一定物质的量浓度的溶液,定容时俯视刻度线,会使所配溶液浓度偏高 | |
| C. | 二氧化硅不与强酸反应,可用石英作为反应容器制取氢氟酸 | |
| D. | 燃着的镁条伸入盛满二氧化碳的集气瓶中,不能继续燃烧 |
1.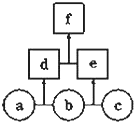 如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
 如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物.则下列说法错误的是( )| A. | d和e分子中所有原子都不满足8电子结构 | |
| B. | 单质c的氧化性强于单质a | |
| C. | 相同状况下,单质c、a、b的沸点逐渐减小 | |
| D. | f可电离生成两种含10个电子的离子 |
19.短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W.下列说法正确的是( )
| A. | 简单离子半径:W>Z>Y | |
| B. | X与W能形成共价化合物 | |
| C. | Y与Z组成的化合物溶于水呈酸性 | |
| D. | 元素X、Y、W的最高化合价均与其族序数相等 |

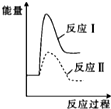
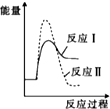
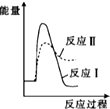

 .
. Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.