题目内容
16.偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.(1)NH4VO3中钒的化合价为+5;已知钒(V)的原子序数为23,试判断V元素在元素周期表中是否为主族元素:否(填“是”、“否”或“无法判断”).
(2)偏钒酸铵在常温下稳定,加热时易分解.它在空气中分解能得到V2O5,试写出偏钒酸铵分解的方程式:2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3↑+H2O,该反应属于非氧化还原反应(填“氧化还原反应”或“非氧化还原反应”).
(3)钒的氧化物五氧化二钒广泛用于冶金、化工等行业,工业上常用铝热反应得到金属钒,该反应方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,得到1molV,需转移的电子的物质的量为5mol.
(4)钒电池(VRB)是一种活性物质呈循环流动液态的二次电池.某钒电池总反应为VO${\;}_{2}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++V3++H2O.
①放电时钒电池的负极反应式为V2+-e-=V3+,
②用该钒电池进行铁制品上镀铜,铁制品应与电池的负极(填“正极”或“负极”)相连.
分析 (1)依据化合价代数和为0计算解答;钒(V)的原子序数为23,位于周期表第四周期ⅤB族;
(2)偏钒酸铵受热分解生成V2O5和氨气、水,依据反应中是否有化合价变化判断是否是氧化还原反应;
(3)工业上常用V2O5跟金属铝粉发生铝热反应得到金属钒,发生铝热反应生成V和氧化铝;
(4)①放电时为原电池,负极发生氧化反应,+2价钒失去电子生成+3价钒;
②电镀池为电解池,阳极为镀层金属,阴极为镀件.
解答 解(1)NH4VO3中铵根离子为+1价,O为-2价,根据化合物代数和为0,计算得V的化合价为+5价;钒(V)的原子序数为23,核外电子排布为1s22s22p63s23p63d34s2,位于周期表第四周期ⅤB族,
故答案为:+5;否;
(2)偏钒酸铵受热分解生成V2O5和氨气、水,反应的化学方程式为2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3+H2O,元素化合价没有发生变化,不是氧化还原反应,
故答案为:2NH4VO3$\frac{\underline{\;\;△\;\;}}{\;}$V2O5+2NH3+H2O;非氧化还原反应;
(3)工业上常用V2O5跟金属铝粉发生铝热反应得到金属钒,发生铝热反应生成V和氧化铝,反应的方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,反应中V的化合价由+5价降低到0价,则每生成1molV,转移的电子的物质的量为5mol,
故答案为:3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;5;
(4)①放电时为原电池,负极发生氧化反应,+2价钒失去电子生成+3价钒,电极反应式:V2+-e-=V3+;
②电镀池为电解池,阳极为镀层金属,阴极为镀件,铁制品上镀铜铁制品应与电池的负极相连为电解池的阴极;
故答案为:V2+-e-=V3+;负极.
点评 本题考查了金属的冶炼与原电池、电解池知识,明确铝热反应原理及原电池、电解池工作原理是解题关键,侧重于学生的分析能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案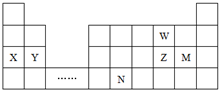
| A. | 原子半径:Y>Z>W | |
| B. | 单质的还原性:X>Y | |
| C. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
| A. | 实验室里易燃试剂与强氧化性试剂应分开放置并远离火源 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 滴定实验中所用到的滴定管和移液管,在使用前均需干燥或用相应的溶液润洗,容量瓶、锥形瓶则不应润洗 | |
| D. | 将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶,过滤即可得到大量硝酸钾晶体 |
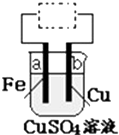 用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )
用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )| A. | 构成原电池时b极反应为:Cu-2e-═Cu2+ | |
| B. | 构成的原电池或电解池工作后就可能产生大量气体 | |
| C. | 构成电解池时b 极质量既可能减少也可能增加 | |
| D. | 构成电解池时a极质量一定会减少 |
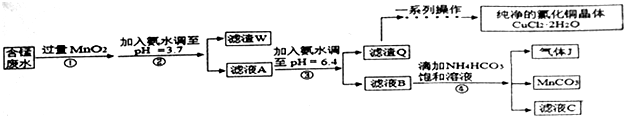
已知:几种金属离子沉淀的pH如表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(2)过程②中,所得滤渣W的成分是Fe(OH)3和过量的MnO2.
(3)过程③中,调pH=6.4目的是使Cu2+ 完全沉淀为Cu(OH)2.
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)将滤渣Q溶解在过量的盐酸中,经过加热浓缩,降温结晶,过滤、洗涤、低温烘干,即可获得纯净的氯化铜晶体(CuCl2•2H2O).
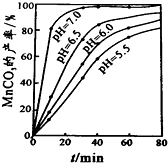
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如图据图中信息,你选择的最佳pH是7.0;理由是pH等于7.0时反应速率最快,且MnCO3产率最高.
(7)从滤液C可得到的副产品是NH4Cl(填化学式).
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-a mol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| A. | 明矾净水原理为:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 该溶液中AlO2-、F-、K+、Na+能大量共存 | |
| C. | 加入过量NH3•H2O反应的离子方程式为:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 加入过量Ba(OH)2溶液反应的离子方程式为:Al3++2SO42-+4OH-+2Ba2+=AlO2-十2BaSO4↓+2H2O |