题目内容
20.等质量的CO2和CO的碳原子数之比为7:11,原子数之比为21:22,氧原子数之比为14:11,含氧的质量之比为14:11.分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算该题.
解答 解:等质量的CO和CO2,由n=$\frac{m}{M}$可知,质量相同,物质的量与摩尔质量成反比,即n(CO):n(CO2)=M(CO2):M(CO)=44:28=11:7;
则CO2和CO的碳原子数之比为7:11;
原子数之比为7×3:11×2=21:22;
氧原子的个数之比等于氧原子的物质的量之比,二者含有的氧原子个数之比为:7×2:11×1=14:11;
含氧的质量之比为14:11,
故答案为:7:11;21:22;14:11;14:11.
点评 本题考查了物质的量与各量的计算应用,明确阿伏伽德罗定律及其推论的分析判断和计算是解答的关键,题目难度中等.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
8.下列化学反应的离子方程式书写正确的是( )
| A. | FeCl3溶液与Cu粉反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+ |
15.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,2.24L CO 和O2 混合气体中含有的碳原子数目为0.1NA | |
| B. | 常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA | |
| C. | 常温常压下,48g O3含有的分子数为3NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
5.对于反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O在测量化学反应速率时,以下不可以利用的相关性质为( )
| A. | 气体的体积和体系的压强 | B. | 溶液颜色的深浅 | ||
| C. | 固体物质的体积 | D. | H+浓度的变化 |
15.下列各组中的两种物质熔化时克服的作用力不同的是( )
| A. | 干冰、SO3晶体 | B. | 食盐、烧碱 | ||
| C. | 氧化镁、冰 | D. | 固态氮气、固态氧气 |
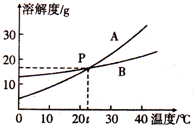 根据图中A、B两种固体物质的溶解度曲线,回答下列问题:
根据图中A、B两种固体物质的溶解度曲线,回答下列问题: 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.