题目内容
13.下列微粒的核外电子排布式所表示的粒子一定属于短周期元素的是( )| A. | 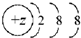 | B. | 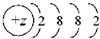 | C. | 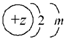 | D. | 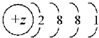 |
分析 第1、2、3周期为短周期,对于原子,电子层数等于周期序数;由于原子失去电子变为阳离子时,电子层数也减少一层,故阳离子的电子层数要少于周期序数;原子在得电子变为阴离子时,电子层数不变,故阴离子的电子层数等于其周期序数,据此分析.
解答 解:A、根据结构示意图可知,若其为原子,则该元素为Ar,为短周期元素;若为阳离子,则该元素为第四周期元素;若为阴离子,则该元素为第三周期元素,故该粒子不一定是短周期元素,故A错误;
B、根据结构示意图可知,此微粒为原子,且有四个电子层,故为第四周期元素,故B错误;
C、根据结构示意图可知,此微粒可能为原子,则为第二周期元素;可能为阳离子,则该元素为第三周期元素;可能为阴离子,则该元素为第二周期元素,故此微粒一定是短周期元素,故C正确;
D、根据结构示意图可知,此微粒一定为原子,且为第四周期元素,故不是短周期,故D错误.
故选C.
点评 本题考查了根据结构示意图来分析微粒的种类,难度不大,应把握住原子变为阳离子时,电子层数减少一层,而变为阴离子时,电子层数不变.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
15.下列实验装置、操作能达到实验目的是( )
| A. |  测定中和热 | B. |  反应快慢 | C. |  粗铜的电解精炼 | D. |  电解食盐水 |
1.下列物质能使有色布条褪色的是( )
| A. | 干燥的氯气 | B. | 潮湿的氯气 | C. | 干燥的次氯酸钙 | D. | 氯化钙 |
8.下列关于锂的说法正确的是( )
| A. | 碱金属中Li的还原性最强 | B. | 碱金属阳离子,氧化性最强的是Li+ | ||
| C. | 和Li同一主族的都是金属元素 | D. | Li在空气中加热生成过氧化锂 |
18.向一定量的Fe、Fe2O3和CuO混合物投入100mL浓度2.2mol/L的硫酸溶液中.充分反应后生成896mL标准状况下的气体.得不溶物1.28g,过滤后.溶液中金属阳离子只有Fe2+.向滤液中加入2mol/L的NaOH溶液.加至40mL时开始出现沉淀.则滤液中FeSO4的物质的量浓度为(设滤液体积为100mL)( )
| A. | 2 mol/L | B. | 1.8 mol/L | C. | 1.9 mol/L | D. | 无法计算 |
5. 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({B}^{-})}{c({A}^{-})}$减小 | |
| C. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| D. | 溶液中水的电离程度:a=c>b |
2.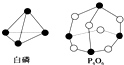 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )
 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )| A. | 放热1638 kJ | B. | 吸热1638 kJ | C. | 吸热3276 kJ | D. | 放热3276 kJ |
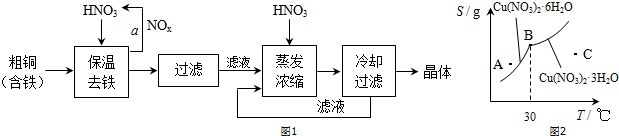
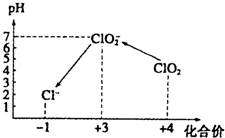 ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种在水处理等方面有广泛应用的高效安全消毒剂.我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.