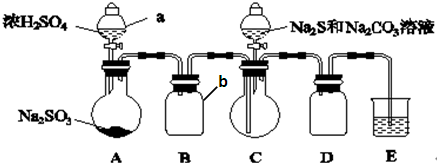
题目内容
2.平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质).某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵: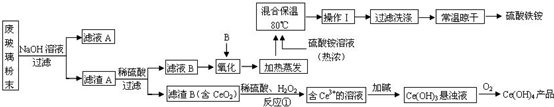
已知:ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性.
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4)3•b(NH4)2SO4•cH2O]广泛用于水的净化处理.
(1)操作Ⅰ的名称是冷却结晶,检验硫酸铁铵溶液中含有Fe3+的方法是:取少量溶液于试管中,加入KSCN溶液,如果出现血红色,说明原溶液中有三价铁.
(2)反应①之前先要洗涤滤渣B,其目的是为了除去Fe3+、Fe2+(填离子符号).
(3)写出反应①的化学方程式2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O.
(4)用滴定法测定制得的Ce(OH)4产品纯度.

滴定时所用定量仪器的读数精确为0.1mL;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数偏大.(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应.则该硫酸铁铵的化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O.
分析 废玻璃粉末加氢氧化钠溶液后过滤,二氧化硅溶于NaOH溶液,然后过滤得到滤渣A的成分是Fe2O3、CeO2、FeO;滤液中含有硅酸钠、NaOH,滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁和硫酸铁溶液,加入氧化剂C可生成硫酸铁,所加物质应避免引入新杂质,则氧化剂是H2O2,将得到的液体蒸发然后加入硫酸铵溶液,得到硫酸铁铵,将溶液冷却结晶、过滤、洗涤、晾干得到硫酸铁铵固体;
滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4;
(1)根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶;铁离子用KSCN溶液检验,铁离子和KSCN溶液混合得到血红色液体;
(2)固体表面可吸附Fe3+、Fe2+;
(3)CeO2与H2O2反应生成Ce2(SO4)3和O2;
(4)滴定时所用定量仪器的最小刻度为0.1ml,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大;
(5)依据铁元素守恒计算氢氧化铁物质的量,依据硫酸根离子守恒和足量守恒计算分析化学式.
解答 解:废玻璃粉末加氢氧化钠溶液后过滤,二氧化硅溶于NaOH溶液,然后过滤得到滤渣A的成分是Fe2O3、CeO2、FeO;滤液中含有硅酸钠、NaOH,滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁和硫酸铁溶液,加入氧化剂C可生成硫酸铁,所加物质应避免引入新杂质,则氧化剂是H2O2,将得到的液体蒸发然后加入硫酸铵溶液,得到硫酸铁铵,将溶液冷却结晶、过滤、洗涤、晾干得到硫酸铁铵固体;
滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4;
(1)根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶;铁离子用KSCN溶液检验,铁离子和KSCN溶液混合得到血红色液体,其检验方法为取少量溶液于试管中,加入KSCN溶液,如果出现血红色,说明原溶液中有三价铁,
故答案为:冷却结晶;取少量溶液于试管中,加入KSCN溶液,如果出现血红色,说明原溶液中有三价铁;
(2)滤渣A的成分是Fe2O3、CeO2、FeO,与硫酸反应后溶液中存在Fe3+、Fe2+,固体表面可吸附Fe3+、Fe2+,所以洗涤的目的是洗去Fe3+、Fe2+,
故答案为:Fe3+、Fe2+;
(3)CeO2与H2O2反应生成Ce2(SO4)3和O2,反应的方程式为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,
故答案为:2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O.
(4)滴定时所用定量仪器的最小刻度为0.1mL,估读0.01ml,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大,测定该Ce(OH)4产品的质量分数会偏大;
故答案为:0.1mL;偏大;
(5)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到沉淀并烘干灼烧至恒重得到1.60g固体为氧化铁,n(Fe2O3)=$\frac{1.60g}{160g/mol}$=0.01mol,生成氢氧化铁沉淀物质的量为,n(Fe(OH)3)=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol,
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O,
故答案为:Fe2(SO4)3•2(NH4)2SO4•2H2O.
点评 本题以工艺流程为基础,考查了化学实验基本操作、元素及化合物知识反应等相关知识,提纯制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和操作方法,难点是(5)题计算,题目难度中等.

(1)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(2)氨气、空气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O.则原电解质溶液显碱性(填“酸性”、“中性”或“碱性”),负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温度/°C | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号);
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400°C时,测得氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1时,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)①25°C时,将amol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
②向25mL0.10mol•L-1的盐酸中滴加氨水至过量,该过程中离子浓度大小关系一定不正确的是d (填字母序号).
a.c(Cl-)>c(H+)>c(NH4+)>c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏小 | |
| B. | 滴定实验时,锥形瓶用蒸馏水洗净后,直接盛待测液 | |
| C. | 用洁净的玻璃棒蘸取新制氯水,滴在pH 试纸上,然后与比色卡对照,可测定新制氯水的pH 值 | |
| D. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其的反应速率 |
| A. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| B. | 分子式为C7H16的有机物中有三种不同化学环境的氢原子,此有机物一定是2,4-二甲基戊烷或3,3-二甲基戊烷 | |
| C. | 完全燃烧等质量的甲醛、乙酸、葡萄糖、蔗糖消耗的氧气量相等 | |
| D. | 还原性染料靛蓝的结构简式为: ,它的分子式是:C16H10N2O2 ,它的分子式是:C16H10N2O2 |
| A. | 将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体 | |
| B. | 焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀硫酸洗净并灼烧 | |
| C. | 中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果 | |
| D. | 移液管取液后,将移液管垂直伸入容器里面,松开食指使溶液全部流出,数秒后,取出移液管 |

| A. | 过程①中,FeS和O2、H2SO4反应的化学方程式是4FeS+3O2+6H2SO4═2Fe2(SO4)3+6H2O+4S | |
| B. | 过程②中产生的气体会对大气造成污染,可选用蒸馏水吸收 | |
| C. | 过程③中,需要加入的物质名称是稀硫酸 | |
| D. | 过程④中的实验操作是蒸发结晶、冷却、过滤、洗涤 |
| A. | 晶体区别于非晶体的本质特征是晶体中原子呈周期性有序排列 | |
| B. | 缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为的立方体晶体体现了晶体的自范性 | |
| C. | M为第ⅡA元素,MCO3中M2+半径越大,MCO3热分解温度越低 | |
| D. | 干冰中CO2的配位数12大于冰中H2O的配位数4,是由于丙中水分子之间存在氢键 |