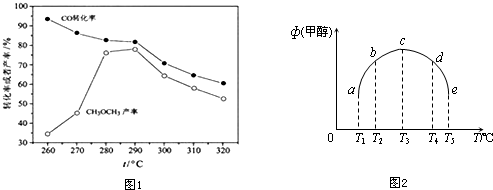
题目内容
13.下列有关实验的说法不正确的是( )| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏小 | |
| B. | 滴定实验时,锥形瓶用蒸馏水洗净后,直接盛待测液 | |
| C. | 用洁净的玻璃棒蘸取新制氯水,滴在pH 试纸上,然后与比色卡对照,可测定新制氯水的pH 值 | |
| D. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其的反应速率 |
分析 A.湿润的pH值试纸可以稀释碱液;
B.中和滴定时,锥形瓶无需用待测液润洗;
C.氯水中的次氯酸能漂白pH试纸;
D.S为固体,不能用固体表示反应速率.
解答 解:A.湿润的pH值试纸可以稀释碱液,溶液中氢氧根离子根据减小,测定的溶液碱性减弱,测定值偏小,故A正确;
B.中和滴定时,锥形瓶无需用待测液润洗,否则引起误差偏大,故B正确;
C.氯水中的次氯酸能漂白pH试纸,不能用pH试纸测定新制氯水的pH值,故C正确;
D.S为固体,不能用固体表示反应速率,故D错误.
故选D.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
4.一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H>0.现将1molA和2molB加入 甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
1.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中( )


| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+ |
8.下列说法正确的是( )
| A. | 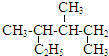 的系统命名是3,4-二甲基己烷 的系统命名是3,4-二甲基己烷 | |
| B. | 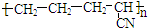 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 | |
| C. | 等质量的甲醛和乳酸[CH3CH(OH)COOH]完全燃烧消耗的氧气不相等,但生成水的质量相等 | |
| D. | 分析反应: ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 |
 2CH3CHO+2H2O.
2CH3CHO+2H2O.