题目内容
3.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:步骤一:配制100mL 0.1000mol/LNaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.50 | 20.40 |
| 第二次 | 20.00 | 1.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.10 |
A、移液管 B、量筒 C、碱式滴定管 D、酸式滴定管
(2)滴定达到终点的现象最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色;
(3)根据上述数据,可计算出该盐酸的浓度为0.1000mol/L.
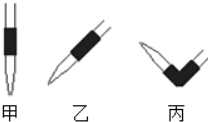
(4)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有ADEF(多选扣分):
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
F.称量前NaOH固体中混有Na2CO3固体.
分析 (1)准确量取20.00mL待测盐酸,要使用精密仪器,不能用碱式滴定管;
(2)根据指示剂为酚酞,滴定结束前溶液为无色,滴定结束时溶液变成浅红色进行判断滴定终点;
(3)根据滴定消耗的标准液的体积判断数据的有效性,然后计算出标准液的平均体积,最后根据标c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算出该盐酸的浓度;
(4)根据正确排去碱式滴定管中气泡的方法进行分析;
(5)根据操作对c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$的影响分析能够导致测定结果偏高的选项.
解答 解:(1)准确量取20.00mL待测盐酸,要使用精密仪器,不能用碱式滴定管,可用移液管和酸式滴定管,
故答案为:AD;
(2)滴定结束前盐酸中滴入酚酞,溶液为无色,滴定结束时氢氧化钠过量,溶液变成浅红色,所以滴定终点现象为:最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色,
故答案为:最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色;
(3)三次滴定数据第二次是无效的,消耗标准液的平均体积为(19.90+20.10)mL÷2=20.00 mL,
该盐酸的浓度为:c(HCl)$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.1000mol•{L}^{-1}×20.00×1{0}^{-3}L}{20.00×1{0}^{-3}L}$=0.1000mol/L,
故答案为:0.1000mol/L;
(4)碱式滴定管装满溶液后,用拇指和食指拿住玻璃球所在部位并使乳胶管向上弯曲,出口管斜向上,然后在玻璃球部位侧面迅速捏橡皮管,使溶液从管口喷出,所以丙正确,
故答案为:丙;
(5)根据操作对c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$的影响分析能够导致测定结果偏高的选项;
A.配制标准溶液定容时,加水超过刻度,使标准液的浓度降低,在实验过程中所用标准液的体积会增多,导致结果偏高,故A正确;
B.锥形瓶水洗后直接装待测液,对待测液的物质的量不影响,滴定时对标准液的体积没有影响,测定结果不变,故B错误;
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,导致待测液浓度减小,消耗的标准液体积减小,测定结果偏低,故C错误;
D.滴定终点读数时仰视读数,导致消耗标准液的体积读数偏高,测定结果偏高,故D正确;
E.碱式滴定管尖嘴部分有气泡,滴定后消失,导致消耗的标准液体积读数偏大,测定结果偏高,故E正确;
F.称量前NaOH固体中混有Na2CO3固体,等质量的碳酸钠和氢氧化钠,碳酸钠消耗的盐酸偏低,在滴定时消耗的标准液体积偏大,测定结果偏高,故F正确;
故答案为:ADEF.
点评 本题考查了中和滴定及误差分析,要求选择掌握中和滴定的操作方法及完成分析的方法,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案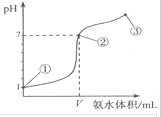 常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )
常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )| A. | 用0.1mol/LNa0H溶液代替氨水滴定盐酸达到点②时所消耗的Na0H的体积也是VmL | |
| B. | 从开始滴定后的任意一点:溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 从点①到点③的滴定过程中:水的电离程度都增大 | |
| D. | 在点②所示溶液中:c(Cl-)=c(NH4+)>c(H+),且V=20 |
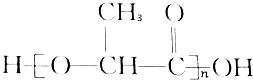 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的单体是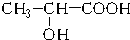 | ||
| C. | 聚乳酸是一种羧酸 | D. | 其聚合方式和乙烯相同 |
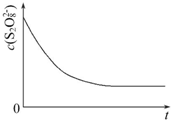 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s)═2LiI(s)△H
已知:①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则电池反应的△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$;碘电极作为该电池的正极.
| A. | 苯与液溴在FeBr3的催化作用下,发生取代反应 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 葡萄糖、蔗糖、淀粉在催化剂作用下,均可以发生水解反应 |
| A. | 1.0mol/L的硝酸钾溶液中:Mg2+,Fe2+、Cl-、SO42- | |
| B. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:Ca2+,K+、Br-、HCO3- | |
| C. | 在pH=1的溶液中:NH4+、Na+、ClO-、Cl- | |
| D. | 无色溶液中:Al3+、Na+、S2-、Cl- |
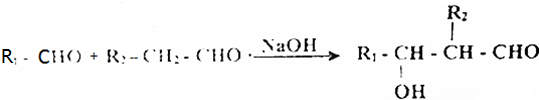
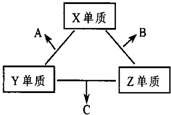 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化: