题目内容
5.草酸氧钛钡晶体[化学式为BaTi(C2O4)2•4H2O]是制造电子陶瓷原料钛酸钡的重要中间体,可通过以下工艺流程制备.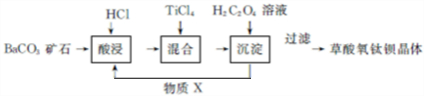
回答下列问题:
(1)酸浸时发生的反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O;为提高BaCO3的酸浸率,可采取的措施为将碳酸钡矿石粉碎(写出一条).
(2)可循环使用的物质X的电子式为
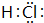 .
.(3)结合流程判断,草酸氧钛钡不能(填“能”或“不能”)溶于稀盐酸.
(4)TiCl4(沸点137℃)露置在空气中会迅速与空气中的水反应,有白雾产生,生成的白色二氧化钛粉末用途广泛,写出反应的化学方程式:TiCl4+2H2O=TiO2+HCl↑.工业上用氯化法制得的粗四氯化钛中常混有SiCl4(沸点57.6℃)、VOCl3(沸点127.2℃),可用蒸馏法除去SiCl4;不能用该法除去VOCl3,原因是VOCl3与TiCl4的沸点相差太小.
(5)单质钛是一种性能优异的稀有金属,在军事、航天、医学等领域有广泛用途.以TiCl4和金属镁为原料制取金属钛的化学方程式为TiCl4+2Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgCl2+Ti.
分析 碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)2•4H2O,同时得到X为HCl,HCl再循环利用,经过过滤、洗涤、干燥得到草酸氧钛钡晶体.
(1)酸浸时碳酸钡与盐酸反应生成氯化钡、二氧化碳与水;搅拌、增大固体的接触面积,可提高反应速率;
(2)物质X为HCl,氢原子与氯原子之间形成1对共用电子对;
(3)生成草酸氧钛钡晶体同时也生成HCl,说明草酸氧钛钡不能溶于稀盐酸;
(4)TiCl4露置在空气中会迅速与空气中的水反应,有白雾产生,生成的白色二氧化钛,白雾是由生成HCl与空气中水蒸气结合形成的小液滴;
由物质的沸点可知,SiCl4与TiCl4的沸点相差比较大,可以用蒸馏的方法除去SiCl4,而VOCl3与TiCl4的沸点相差不大,不能用蒸馏方法除去;
(5)TiCl4和金属镁发生置换反应生成Ti与MgCl2.
解答 解:碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)2•4H2O,同时得到X为HCl,HCl再循环利用,经过过滤、洗涤、干燥得到草酸氧钛钡晶体.
(1)酸浸时碳酸钡与盐酸反应生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,将碳酸钡矿石粉碎、搅拌等,可提高反应速率,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;将碳酸钡矿石粉碎;
(2)物质X为HCl,电子式为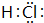 ,故答案为:
,故答案为: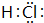 ;
;
(3)生成草酸氧钛钡晶体同时也生成HCl,说明草酸氧钛钡不能溶于稀盐酸,故答案为:不能;
(4)TiCl4露置在空气中会迅速与空气中的水反应,有白雾产生,生成的白色二氧化钛,白雾是由生成HCl与空气中水蒸气结合形成的小液滴,反应方程式为:TiCl4+2H2O=TiO2+HCl↑,
由物质的沸点可知,SiCl4与TiCl4的沸点相差比较大,可以用蒸馏的方法除去SiCl4,而VOCl3与TiCl4的沸点相差不大,不能用蒸馏方法除去,
故答案为:TiCl4+2H2O=TiO2+HCl↑;蒸馏;VOCl3与TiCl4的沸点相差太小;
(5)TiCl4和金属镁发生置换反应生成Ti与MgCl2,反应方程式为:TiCl4+2Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgCl2+Ti,
故答案为:TiCl4+2Mg$\frac{\underline{\;\;△\;\;}}{\;}$2MgCl2+Ti.
点评 本题考查物质制备工艺流程,涉及对操作的分析评价、对信息获取与应用等,侧重对化学用语的考查,熟练掌握元素化合物知识,题目难度中等.

| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| A. | 它位于周期表的第四周期、第ⅠA族 | |
| B. | 在钠、钾、铷三种单质中,相同条件下铷与水的反应速率最小 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 硝酸铷是离子化合物 |
| A. | 一定条件下,使用催化剂能加快反应速率和提高反应物转化率 | |
| B. | 常温下,向水中滴加少量酸形成稀溶液,溶液中c(OH-)和水的离子积常数Kw均不变 | |
| C. | 在锌与足量稀硫酸反应溶液中加入少量铜粉溶液,可以加快反应速率但不影响产生氢气的量 | |
| D. | 在密闭绝热的容器中发生2SO2+O2?2SO3反应,当反应容器温度恒定时,反应达到平衡 |
| A. | 铜极为负极 | B. | 电子从铜沿导线转移到铁 | ||
| C. | 铁表面析出金属铜 | D. | 总反应为Fe+CuSO4=FeSO4+Cu |
| A. | 和锂同一主族的都是金属元素 | B. | LiOH的碱性比NaOH的弱 | ||
| C. | 锂的化学性质不如钠活泼 | D. | Li在空气中燃烧生成Li2O |

 .
.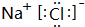 .
.