题目内容
15.已知 可简写为
可简写为
Ⅰ.降冰片烯的分子结构可表示为:
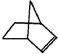
(1)降冰片烯属于b.
a.环烷烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯不具有的性质ad.
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
Ⅱ.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
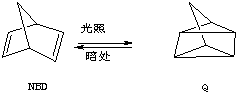
(1)NBD有多种同分异构体,其中属芳香烃的只有一种,其结构简式为
 ,系统命名为甲苯.
,系统命名为甲苯.(2)四环烷(Q)一氯代物共有3种.
分析 Ⅰ.(1)降冰片烯为环状烃,且含有碳碳双键;
(2)含有C=C键,结合烯烃的性质来分析解答;
Ⅱ.(1)根据C原子数可判断属于芳香烃的为甲苯;
(2)物质Q中含有3种氢原子.
解答 Ⅰ.(1)降冰片烯为环状烃,且含有碳碳双键,则属于环烃,也属于烯烃,不含苯环,则不属于芳香烃,故答案为:b;
(2)含有C=C键,具有烯烃的性质,则不溶于水,常温常压下不为气体,能发生加成反应和氧化反应,故答案为:a、d;
Ⅱ.(1)NBD的分子式为C7H8,属于芳香烃的为甲苯,结构简式为 ,故答案为:
,故答案为: ;甲苯;
;甲苯;
(2)物质Q中含有3种氢原子,一氯代物共有3种,故答案为:3.
点评 本题考查有机物的结构和性质,为高考常见题型,明确有机物的结构与性质的关系即可解答,注意把握烯烃的性质来解答,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
6.A、B均是原子序数为1~18的元素中的一种,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是( )
| A. | n+4 | B. | n+6 | C. | n+8 | D. | n+10 |
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Na2O2和足量CO2反应转移2 NA个电子 | |
| C. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
4.1g火箭燃料N2H4燃烧,生成N2和H2O(g),同时放出16.7kJ的热量,表示该反应的热化学方程式正确的是( )
| A. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-1 | |
| B. | N2H4+O2═N2+2H2O△H=-1 068.8 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4 kJ•mol-1 | |
| D. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267.2 kJ•mol-1 |
5.工业上回收利用某合金废料(主要含Fe、Cu、Al、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
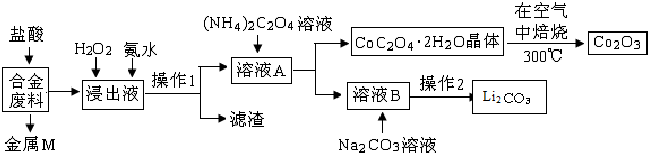
已知:Ksp[Cu(OH)2]=4.0×10-21,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-19.pH=7.3时Li+或Co3+开始沉淀.
(1)金属M为Cu.
(2)①加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O.
②氨水的作用是调节溶液的pH,室温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol•L-1).需调节溶液pH范围为5.0<pH<7.3.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失.
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为2CO32--4e-=O2↑+CO2↑.
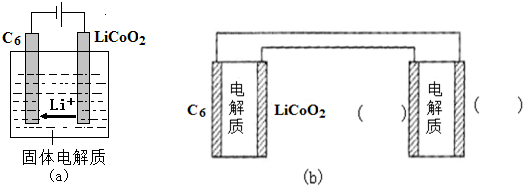
(6)①用Li、Co形成某锂离子电池的正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图a).电池反应为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2,
写出该电池放电时的负极反应式LixC6-xe-=C6+xLi+.
②锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极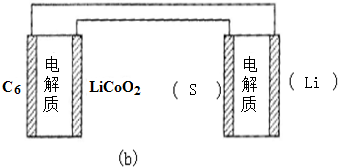 中填写“Li”或“S”,以达到给锂硫电池充电的目的.
中填写“Li”或“S”,以达到给锂硫电池充电的目的.

已知:Ksp[Cu(OH)2]=4.0×10-21,Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-19.pH=7.3时Li+或Co3+开始沉淀.
(1)金属M为Cu.
(2)①加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O.
②氨水的作用是调节溶液的pH,室温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol•L-1).需调节溶液pH范围为5.0<pH<7.3.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(6)①用Li、Co形成某锂离子电池的正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图a).电池反应为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2,
写出该电池放电时的负极反应式LixC6-xe-=C6+xLi+.
②锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S,图b表示用锂离子电池给锂硫电池充电,请在图b的电极
 中填写“Li”或“S”,以达到给锂硫电池充电的目的.
中填写“Li”或“S”,以达到给锂硫电池充电的目的.
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.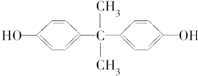 ).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题:
).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题: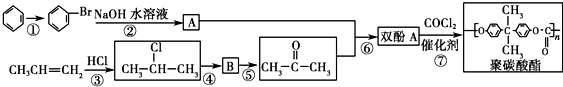
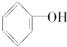 .
.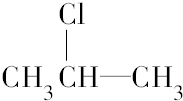 按系统命名法的名称为2-氯丙烷.
按系统命名法的名称为2-氯丙烷.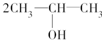 +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$ +2H2O.
+2H2O.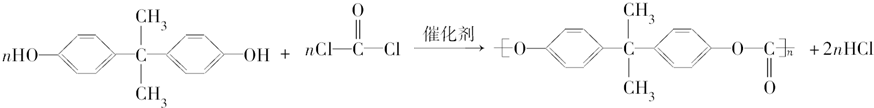 ,
,