题目内容
5.试用化学方法除去下列物质中混有的少量杂质,若为离子反应请写出其离子方程式,否则写化学方程式.(1)除去FeCl2溶液中混有的少量FeCl3;方程式:2Fe3++Fe=3Fe2+.
(2)除去CO2气体中混有的少量HCl;方程式:H++HCO3-=CO2↑+H2O.
(3)除去Fe2O3混有的少量Al2O3;方程式:Al2O3+2OH-=2AlO2-+H2O.
分析 (1)除去FeCl2溶液中混有的少量FeCl3,可加入适量铁粉将氯化铁还原成氯化亚铁;
(2)除去CO2气体中混有的少量HCl,可将混合气体通入饱和碳酸氢钠溶液洗气;
(3)根据氧化铝为离子氧化物,可用氢氧化钠溶液除去Fe2O3混有的少量Al2O3.
解答 解:(1)除去FeCl2溶液中混有的少量FeCl3:可用还原铁粉将铁离子还原成亚铁离子,反应的了脂肪酸为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(2)除去CO2气体中混有的少量HCl:二氧化碳不与碳酸氢钠反应,氯化氢能够与碳酸氢钠反应生成氯化钠、二氧化碳气体和水,可将混合气体通入饱和碳酸氢钠溶液洗气,反应的离子方程式为:,
故答案为:H++HCO3-=CO2↑+H2O;
(3)除去Fe2O3混有的少量Al2O3:氧化铝能够与氢氧化钠溶液反应,而氧化铁不与氢氧化钠溶液反应,可用氢氧化钠溶液除去杂质氧化铝,反应的了脂肪酸为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查了物质的分离与除杂、离子方程式书写,题目难度中等,正确选用除杂试剂为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
15.将浑浊的河水制成蒸馏水,正确的方法是( )
| A. | 过滤 | B. | 蒸发 | ||
| C. | 先过滤后蒸馏 | D. | 加入某种药品溶解浑浊的固体 |
16.在水溶液中能大量共存的一组离子是( )
| A. | H+、SO42-、Na+、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | H+、I-、Cl-、NO3- | D. | K+、SO42-、Mg2+、NO3- |
20.将Na2O2投入FeCl3溶液中,可观察到的实验现象是( )
| A. | 有白色沉淀生成 | |
| B. | 有红棕色沉淀生成 | |
| C. | 没有沉淀生成 | |
| D. | 既有红褐色沉淀生成又有无色气体产生 |
10.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 17 g H2O2中含有9NA个质子 | |
| B. | 1 L 0.1 mol•L-1CuSO4溶液中含0.1NA个Cu2+ | |
| C. | 1 mol Fe 与过量的稀HNO3反应,转移2 NA个电子 | |
| D. | 标准状况下,22.4 L SO3含有3NA氯原子 |
14.下列说法正确的是( )
| A. | 浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 | |
| B. | 在任何条件下都不能发生Cu+H2SO4═CuSO4+H2↑反应 | |
| C. | 浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 | |
| D. | 二氧化氮与水反应的离子方程式是3NO2+H2O═2HNO3+NO |
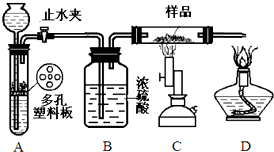
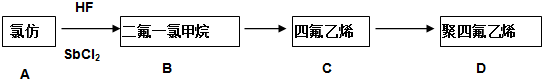
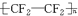 .
. 可简写为
可简写为
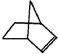
 ,系统命名为甲苯.
,系统命名为甲苯.