题目内容
6.A、B均是原子序数为1~18的元素中的一种,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是( )| A. | n+4 | B. | n+6 | C. | n+8 | D. | n+10 |
分析 阳离子的电子数=原子序数-电荷数,阴离子的电子数=原子序数+电荷数,以此来解答.
解答 解:A的原子序数为n,A2+离子比B2-离子少8个电子,设B的原子序数为x,
则(x+2)-(n-2)=8,
解得x=n+4,
故选A.
点评 本题考查电子数的关系,明确原子序数等于质子数、电荷数与电子数的关系是解答本题的关键,题目较简单.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
16.在水溶液中能大量共存的一组离子是( )
| A. | H+、SO42-、Na+、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | H+、I-、Cl-、NO3- | D. | K+、SO42-、Mg2+、NO3- |
14.下列说法正确的是( )
| A. | 浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 | |
| B. | 在任何条件下都不能发生Cu+H2SO4═CuSO4+H2↑反应 | |
| C. | 浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 | |
| D. | 二氧化氮与水反应的离子方程式是3NO2+H2O═2HNO3+NO |
11.下列叙述中不正确的是( )
| A. | N和P同一主族,其简单氢化物的沸点NH3>PH3 | |
| B. | 0.5摩尔氧化钠和过氧化钠的混合物中阴阳离子的总数为1.5NA | |
| C. | 在标准状况下22.4L SO3的物质的量约为1摩尔 | |
| D. | 已知P4分子是正四面体结构,31g白磷中含有1.5NA个P-P非极性键 |
18.A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成.B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC.
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
(2)下表为B与F实验的部分内容
写出B与稀H2SO4反应的离子方程式S2O32-+2H+=S↓+SO2↑+H2O,写出②中离子反应方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
(3)现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4-需氧化剂的物质的量为2.5mol.
(4)化合物D和E相互转化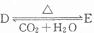 ,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC.
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
(2)下表为B与F实验的部分内容
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
(3)现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4-需氧化剂的物质的量为2.5mol.
(4)化合物D和E相互转化
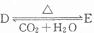 ,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O. 
 .
. .
. 可简写为
可简写为
 ,系统命名为甲苯.
,系统命名为甲苯.