题目内容
13.据氧化还原反应:2Fe3+(aq)+Fe(s)=3Fe2+(aq),设计原电池并完成如图所示实验.
请回答下列问题:
(1)电极X的材料是Fe;石墨电极为电池的正极.
(2)B装置中发生的电极反应方程式为Fe3++e-═Fe2+;表面皿中溶质Na2SO4的作用是增强溶液的导电性.
(3)铜丝b与滤纸接触处的现象为滤纸变为红色.
分析 由图可知,X为Fe,作负极,电极反应为Fe-2e-═Fe2+;石墨为正极,电极反应为2Fe3++2e-═2Fe2+;则a为阳极,b为阴极,电解硫酸钠溶液,实质为电解水,以此来解答.
解答 解:(1)由电池反应2Fe3+(aq)+Fe(s)═3Fe2+(aq)可知,Fe失去电子,则电极材料X为铁,石墨电极为正极,故答案为:Fe;正;
(2)B装置中发生的电极反应方程式为Fe3++e-═Fe2+,表面皿中溶质Na2SO4的作用是增强溶液的导电性,故答案为:Fe3++e-═Fe2+;增强溶液的导电性;
(3)铜丝b与电源负极相连,为阴极,发生电极反应为2H2O+2e-═H2↑+2OH-,则滤纸接触处有碱和酚酞,可观察到的现象为滤纸变为红色,
故答案为:滤纸变为红色.
点评 本题考查原电池的设计及应用,为高频考点,把握原电池、电解的工作原理为解答的关键,侧重分析与应用能力的考查,注意电极反应的书写,题目难度不大.

练习册系列答案
相关题目
4.一种由氯化铵制取氯气的工艺原理如下:
反应Ⅰ.2NH4Cl+MgO$\frac{\underline{\;500~550℃\;}}{\;}$2NH3↑+MgCl2+H2O↑
反应Ⅱ.2MgCl2+O2$\frac{\underline{\;800~1000℃\;}}{\;}$2MgO+2Cl2
下列说法正确的是( )
反应Ⅰ.2NH4Cl+MgO$\frac{\underline{\;500~550℃\;}}{\;}$2NH3↑+MgCl2+H2O↑
反应Ⅱ.2MgCl2+O2$\frac{\underline{\;800~1000℃\;}}{\;}$2MgO+2Cl2
下列说法正确的是( )
| A. | 该工艺中MgO可循环利用 | |
| B. | 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L | |
| C. | 在800~1000℃条件下,O2的还原性强于Cl2的还原性 | |
| D. | 若反应2NH3+MgCl2+H2O═2NH4Cl+MgO能自发进行,则该反应△H>0 |
8.以下现象与电化学腐蚀无关的是( )
| A. | 纯银物品久置表面变暗 | |
| B. | 生铁(含有碳等杂质)比纯铁在潮湿的环境中容易生锈 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
5.下列说法正确的是( )
| A. | H2S溶液中只存在2个电离平衡 | |
| B. | c(OH-)=$\sqrt{{K}_{w}}$的溶液一定呈中性 | |
| C. | 加热碳酸钠溶液可证明其水解是吸热反应 | |
| D. | 常温下,在AlPO4和FePO4的饱和溶液中滴加少量Na3PO4溶液,Ksp(AlPO4)和Ksp(FePO4)将减小 |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24 L乙醇中碳氢键的数目为0.5 NA | |
| B. | 1 L 0.1 mol•L-1硫酸钠溶液中含有的氧原子数为0.4 NA | |
| C. | 0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 NA | |
| D. | 0.1 mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA |
15.30mL 5mol/LNaOH溶液中NaOH的质量为( )
| A. | 4g | B. | 5g | C. | 6g | D. | 7g |
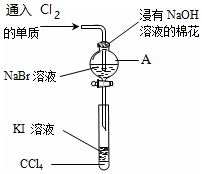 为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,
为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,