题目内容
1.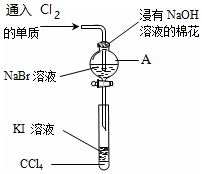 为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,
为了验证VIIA族部分元素非金属性递变规律,设计如图进行实验,(1)仪器A的名称是分液漏斗,A中发生反应的离子方程式是2Br-+Cl2=Br2+2Cl-;
(2)为了验证溴和碘的非金属性强弱,通入Cl2单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡,静置,可观察到的现象的溶液分层,上层几乎无色,下层呈紫红色;
(3)VJIA族元素,非金属性随着原子序数的增加而逐渐减弱的原因:同主族元素从上到下,核电荷数增加,原子半径增,得电能力减弱.
(4)阅读上述实验操作步骤,为确保实验结论可靠,你认为做好本实验最关键的因素是氯水滴加少量.
分析 (1)由图可知,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应;
(2)溴与KI反应生成碘,碘易溶于四氯化碳;
(3)同主族元素从上到下,电子层、原子半径均增大,得到电子能力减弱;
(4)氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果.
解答 解:(1)由图可知,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应,该离子反应为:2Br-+Cl2=Br2+2Cl-,
故答案为:分液漏斗;2Br-+Cl2=Br2+2Cl-;
(2)溴与KI反应生成碘,碘易溶于四氯化碳,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色,
故答案为:溶液分层,上层几乎无色,下层呈紫红色;
(3)综上所述,由实验可知同主族元素从上到下,电子层数增多,原子半径逐渐增大,得到电子能力减弱,非金属性随元素核电荷数增加而逐渐减弱,
故答案为:核电荷数增加,原子半径增;
(4)若通入过量氯气,剩余的氯气能够进入试管氧化碘离子,干扰了溴与碘离子的反应,所以为确保实验结论可靠,做好本实验最关键的因素是氯水滴加少量,
故答案为:氯水滴加少量.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验原理为解答关键,注意掌握原子结构与元素周期律的关系,试题有利于提高学生的分析能力及化学实验能力.

练习册系列答案
相关题目
1.下列措施中,能使饱和食盐水中c(OH-)减小的是( )
| A. | 加热 | B. | 投入金属钠 | C. | 加入NaHSO4固体 | D. | 以惰性电极电解 |
12.据报道,月球上有大量3He存在,以下关于3He的说法正确的是( )
| A. | 和4He是同一种原子 | B. | 比4He少一个质子 | ||
| C. | 是4He的同位素 | D. | 比4He多一个中子 |
10.下列属于氧化还原反应的是( )
| A. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | 2KI+Br2═2KBr+I2 | D. | MgO+2HCl═MgCl2+H2O |
3.下列有关化学实验的操作中,一般情况下不能相互接触的是( )
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗下端管口与烧杯内壁 | |
| C. | 分液操作中,分液漏斗下端管口与烧杯内壁 | |
| D. | 用胶头滴管向试管滴加液体时,滴管尖端与试管内壁 |
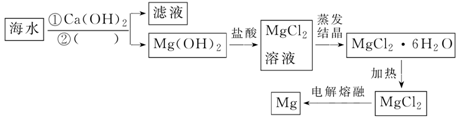
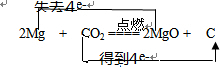 .
.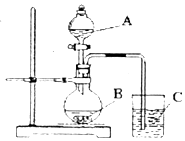 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律. ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.