题目内容
18.醋酸是一种常见的弱酸.假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为1.3×10-3mol/L;计算此时醋酸的电离平衡常数Ka(CH3COOH)=1.7×10-5mol/L.[注:c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计].
分析 醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,由于溶液pH较小,则c(CH3COO-)=c(H+),根据K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$计算此时醋酸的电离平衡常数.
解答 解:醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,用于溶液pH较小,则c(CH3COO-)=c(H+)1.3×10-3=mol/L,
Ka(CH3COOH)=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{(1.3×1{0}^{-3})^{2}}{0.1}$=1.7×10-5mol/L,
故答案为:1.3×10-3;1.7×10-5mol/L.
点评 本题考查了弱电解质在水溶液中的电离平衡,题目难度中等,明确电离平衡常数的概念及表达式为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
10.下列属于氧化还原反应的是( )
| A. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | 2KI+Br2═2KBr+I2 | D. | MgO+2HCl═MgCl2+H2O |
7.某有机物含C、H、O、N四种元素,其3D模型如图所示.下列有关该有机物的说法正确的是( )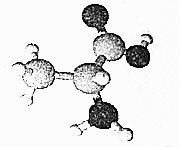

| A. | 常温常压下呈气态 | |
| B. | 分子式为C3H8O2N | |
| C. | 与H2NCH2COOH互为同系物 | |
| D. | 分子中所有C、N原子均处于同一平面 |
20.某粒子质量数为19,中子数为10,电子数为10,则它的化学符号最合理的是( )
| A. | 199F- | B. | 1910Ne | C. | 2910F | D. | 2919K+ |
 .
. ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.