题目内容
下列离子方程式书写不正确的是( )
| A、氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | ||||
B、等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合:Ca2++2HC
| ||||
C、用氢氧化钠溶液吸收少量二氧化碳:2OH-+CO2=C
| ||||
| D、将CO2通入次氯酸钙溶液可生成次氯酸:CO2+H2O+Ca2++2ClO-=CaCO3↓+2HClO |
考点:离子方程式的书写
专题:离子反应专题
分析:A.氯气具有强氧化性,氯气能够与亚铁离子发生氧化还原反应生成铁离子和氯离子;
B.碳酸氢钙与氢氧化钠的物质的量相等,氢氧根离子不足,碳酸氢根离子有剩余;
C.二氧化碳少量,氢氧根离子与二氧化碳反应生成碳酸根离子和水;
D.碳酸酸性大于次氯酸,次氯酸钙溶液中通入二氧化碳,反应生成碳酸钙沉淀和次氯酸.
B.碳酸氢钙与氢氧化钠的物质的量相等,氢氧根离子不足,碳酸氢根离子有剩余;
C.二氧化碳少量,氢氧根离子与二氧化碳反应生成碳酸根离子和水;
D.碳酸酸性大于次氯酸,次氯酸钙溶液中通入二氧化碳,反应生成碳酸钙沉淀和次氯酸.
解答:
解:A.氯气通入氯化亚铁溶液中,亚铁离子被氧化成铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故A正确;
B.等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合,氢氧化钠不足,碳酸氢根离子部分参与反应,正确的离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故B错误;
C.用氢氧化钠溶液吸收少量二氧化碳,反应生成碳酸根离子和水,反应的离子方程式为:2OH-+CO2=CO32-+H2O,故C正确;
D.碳酸酸性大于次氯酸,将CO2通入次氯酸钙溶液可生成次氯酸,反应的离子方程式为:CO2+H2O+Ca2++2ClO-=CaCO3↓+2HClO,故D正确;
故选B.
B.等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合,氢氧化钠不足,碳酸氢根离子部分参与反应,正确的离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故B错误;
C.用氢氧化钠溶液吸收少量二氧化碳,反应生成碳酸根离子和水,反应的离子方程式为:2OH-+CO2=CO32-+H2O,故C正确;
D.碳酸酸性大于次氯酸,将CO2通入次氯酸钙溶液可生成次氯酸,反应的离子方程式为:CO2+H2O+Ca2++2ClO-=CaCO3↓+2HClO,故D正确;
故选B.
点评:本题考查了离子方程式书写的判断,题目难度再等等,注意掌握方程式书写原则,熟悉常见的需要保留化学式的物质,如难溶物、弱电解质等,特别注意反应物量的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 将如图所示实验装置的K闭合,下列判断正确的是( )
将如图所示实验装置的K闭合,下列判断正确的是( )| A、电子沿Zn→a→b→Cu路径流动 |
| B、Cu电极上发生还原反应 |
| C、片刻后甲池中c(SO42-)增大 |
| D、片刻后可观察到滤纸b点变红色 |
酒后驾车人员体内酒精含量的检测装置如图所示,下列说法正确的是( )


| A、该检测装置实现了将化学能转化为电能,且单位时间内通过电量越大,酒精含量越高 |
| B、电极A是正极 |
| C、电极B的反应:H2O+C2H5OH-4e-=CH3COOH+4H+ |
| D、电池总反应:O2+C2H5OH=CH3COOH+H2O |
对实验Ⅰ~Ⅳ的实验现象判断正确的是( )
A、 实验Ⅰ:产生红褐色沉淀 |
B、 实验Ⅱ:试管中溶液变红色 |
C、 实验Ⅲ:试管中溶液变红色 实验Ⅲ:试管中溶液变红色 |
D、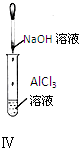 实验Ⅳ:试管中先出现白色沉淀,后溶解 |
下列各组物质的关系的描述不正确的是( )
| A、O2与O3互为同素异形体 |
B、CH2=CH2与  互为同系物. 互为同系物. |
| C、1H、2H、3H互为同位素 |
D、 与 与  互为同分异构体 互为同分异构体 |
下列化学式一定表示一种物质的是( )
| A、CF2Cl2 |
| B、C6H12O6 |
| C、C12H22O11 |
| D、C2H4O2 |
利用如图所示实验装置进行实验,下列说法正确的是( )


| A、电子将沿着Zn→a→b→Cu路径流动 |
| B、片刻后可观察到试纸a点变蓝色 |
| C、反应一段时间,乙池溶液浓度上升 |
| D、锌电极上发生氧化反应 |

 .请推断乳酸的结构简式:
.请推断乳酸的结构简式: