题目内容
11.下列表达方式正确的是( )| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 硫离子结构示意图: | |
| C. | 氢氧根的电子式: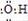 | |
| D. | HClO的结构式:H-O-Cl |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.硫离子的核电荷数为16,不是18;
C.氢氧根离子为阴离子,电子式中需要标出所带电荷;
D.次氯酸分子中含有1个H-O键和1个O-Cl键.
解答 解:A.氯化氢为共价化合物,用电子式表示氯化氢分子的形成过程为: ,故A错误;
,故A错误;
B.硫离子的核电荷数为16,最外层达到8电子稳定结构,硫离子正确的离子结构示意图为: ,故B错误;
,故B错误;
C.氢氧根离子带有1个单位负电荷,其正确的电子式为 ,故C错误;
,故C错误;
D.HClO的中心原子为O原子,其结构式为:H-O-Cl,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
1.关于0.01mol•L-1NaHCO3溶液,下列说法正确的是( )
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)═2[c(H2CO3)+c(HCO3-+c(CO32-)] | |
| D. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
19.下列说法正确的是( )
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温条件下一定很容易发生 | |
| C. | 反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 | |
| D. | 吸热反应在常温条件下一定不会发生 |
6.燃烧1g乙醇(液态)生成CO2气体和液态水放出热量为29.7KJ,则乙醇燃烧的热化学方程式正确的是( )
| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |
 ;
; 由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂.如:
由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂.如: ,其中碳氧原子之间共价键是c(填序号):
,其中碳氧原子之间共价键是c(填序号): .
.