题目内容
6.燃烧1g乙醇(液态)生成CO2气体和液态水放出热量为29.7KJ,则乙醇燃烧的热化学方程式正确的是( )| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |
分析 依据热化学方程式书写方法写出,1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,计算求出46g乙醇完全燃烧放出的热量=29.7KJ×46=1366.2KJ,然后写出热化学方程式.
解答 解:1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为:46×29.7kJ=1366.2kJ,
其燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1;
故选D.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大.

练习册系列答案
相关题目
16.对于Cu-H2SO4-Zn原电池的叙述正确的是( )
| A. | 原电池是将电能直接转化成化学能的装置 | |
| B. | 比较不活泼的金属为负极,负极发生氧化反应 | |
| C. | 正极为电子流入的一极,有气泡产生 | |
| D. | 正极的电极反应式:Zn-2e-=Zn2+,溶液中SO42-向正极移动 |
11.下列表达方式正确的是( )
| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 硫离子结构示意图: | |
| C. | 氢氧根的电子式: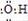 | |
| D. | HClO的结构式:H-O-Cl |
18.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A. | 稀硝酸 | B. | 硫酸 | C. | 氨水 | D. | 氢氧化钠 |
15.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量的之比为1:2,则下列说法中一定不正确的是( )
| A. | 分子不可能是烷烃 | B. | 分子中C、H个数之比为1:4 | ||
| C. | 分子中可能含有氧原子 | D. | 此有机物的最简式为CH4 |
16.东晋葛洪在《抱朴子》中写道“扶南生金刚,生水底石上,如钟乳状,体似紫石英,可以刻玉,人没水取之,虽铁椎之亦不能伤.”文中所述“金刚”可能为( )
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钠 | D. | 二氧化硅 |
 .
.
