题目内容
1.下图所示装置中,甲、乙两个烧杯依次分别盛放100g NaOH溶液、足量的CuSO4溶液,电极均为石墨电极;丙是电解槽,接通电源,经过一段时间后,测得甲中NaOH溶液的质量为95.5g,乙中c电极质量增加,据此回答问题: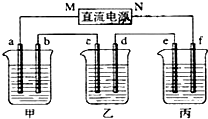
(1)电源的N端为正极.
(2)电极a上发生的电极反应为2H2O+2e-=H2↑+2OH-.
(3)电极b上生成的气体在标准状况下的体积是2.8L
(4)电极c的质量变化是16g.
(5)欲在电解槽丙实现铁上镀锌,则电极e的材料是铁;槽中盛放的电镀液可以是ZnSO4、Zn(NO3)2,电极f上发生的反应为:Zn-2e-=Zn2+.
分析 乙中c电极质量增加,说明c是阴极,铜离子放电生成单质铜,所以M为原电池的负极,N为原电池的正极,甲池是电解水,电解水的质量为100g-95.5g=4.5g,由总的电解方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,进行分析求解.
解答 解:(1)乙中c电极质量增加,说明c是阴极,铜离子放电生成单质铜,所以M为原电池的负极,N为原电池的正极,故答案为:正极;
(2)电极a为阴极,阴极上发生的电极反应为2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
(3)电极b上的电极反应式为:4OH--4e-=O2↑+2H2O,电解水的质量为100g-95.5g=4.5g,
由总的电解方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
36g 22.4L
4.5g V
所以V=$\frac{4.5×22.4}{36}$=2.8L,所以生成的气体在标准状况下的体积是2.8L,故答案为:2.8L;
(4)电极c铜离子放电生成单质铜,根据电子守恒得2Cu~~O2,
2×64g 22.4L
m 2.8L
所以m=$\frac{2×64×2.8}{22.4}$=16g,故答案为:16g;
(5)电镀时,e是阴极,f是阳极,镀层锌作阳极,镀件铁作阴极,阳极上失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质,所以阳极上电极反应式为Zn-2e-=Zn2+;阴极上的电极反应式为Zn2++2e-=Zn;
电镀液的选取:用含有镀层金属离子的溶液作电镀液,所以可选ZnSO4、Zn(NO3)2溶液作电镀液.
故答案为:铁;ZnSO4、Zn(NO3)2;Zn-2e-=Zn2+.
点评 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等,做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.

 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 硫离子结构示意图: | |
| C. | 氢氧根的电子式: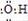 | |
| D. | HClO的结构式:H-O-Cl |
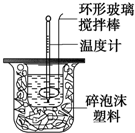 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和氢氧化钠溶液反应表示中和热的热反应化学方程(中和热数值为57.3KJ/mol)NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度;
c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钠 | D. | 二氧化硅 |
| A. | 分子中所有原子都在同一平面内 | |
| B. | 能与溴水发生加成反应使其褪色 | |
| C. | 能与浓HNO3在一定条件下发生取代反应 | |
| D. | 能与酸性KMnO4溶液反应使其褪色 |
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑥ | D. | ①②③⑥ |
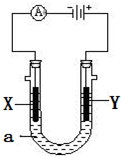 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: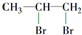 1,2二溴丙烷; ②
1,2二溴丙烷; ②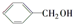 苯甲醇.
苯甲醇. C4H8O; ②
C4H8O; ②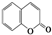 C9H6O2.
C9H6O2.