题目内容
1.关于0.01mol•L-1NaHCO3溶液,下列说法正确的是( )| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)═2[c(H2CO3)+c(HCO3-+c(CO32-)] | |
| D. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
分析 A.碳酸氢钠溶液中碳酸氢根离子水解是碳酸氢根离子结合水电离出的氢离子促进水电离平衡正向进行,水解反应是可逆反应;
B.溶液中存在电荷守恒,阴阳离子所带电荷总数相同;
C.溶液中存在物料守恒,n(C)=n(Na);
D.碳酸氢钠溶液中碳酸氢根离子水解溶液显碱性.
解答 解:A.溶质水解反应:HCO3-+H2O?OH-+H2CO3 ,故A错误;
B.溶液中存在电荷守恒,离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-),故B错误;
C.溶液中存在物料守恒,n(C)=n(Na),微粒浓度关系:c(Na+)═c(H2CO3)+c(HCO3-+c(CO32-),故C错误;
D.碳酸氢钠溶液中碳酸氢根离子水解程度大于电离程度,溶液显碱性,溶液中离子浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故D正确;
故选D.
点评 本题考查了电解质溶液中电荷守恒、物料守恒、离子浓度大小比较、水解过程等知识,题目难度中等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
9.下列物质:①乙烯②乙炔③甲烷④四氯化碳,其中分子具有正四面体型的是( )
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ③④ |
16.对于Cu-H2SO4-Zn原电池的叙述正确的是( )
| A. | 原电池是将电能直接转化成化学能的装置 | |
| B. | 比较不活泼的金属为负极,负极发生氧化反应 | |
| C. | 正极为电子流入的一极,有气泡产生 | |
| D. | 正极的电极反应式:Zn-2e-=Zn2+,溶液中SO42-向正极移动 |
6.漂白粉在空气中易失效的原因是( )
| A. | CaCl2易吸收空气中的水分 | |
| B. | Ca(ClO)2见光易分解 | |
| C. | Ca(ClO)2与空气中的水分和二氧化碳作用,生成HClO | |
| D. | Ca(ClO)2易被空气中的氧气氧化 |
13.下列关于有机物的说法正确的是( )
| A. | 有机物不能通过人工的方法合成 | |
| B. | 有机物只含有碳、氢两种元素 | |
| C. | 含碳元素的化合物不一定都属于有机物 | |
| D. | 烃是指燃烧后只生成CO2和H2O的有机物 |
10. 有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
甲同学提出的问题,乙同学解释不正确的是( )
 有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:| 实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑橘 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
| 甲同学 | 乙同学 | |
| A | 实验6中的负极电极反应如何写? | 铝为负极:Al-3e-═Al3+ |
| B | 实验1,5电流方向为什么相反? | 1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
| C | 水果电池的电压与哪些因素有关? | 只跟水果的类型有关 |
| D | 实验中发光二极管不太亮,如何使它更明亮起来? | 可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
| A. | A | B. | B | C. | C | D. | D |
11.下列表达方式正确的是( )
| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 硫离子结构示意图: | |
| C. | 氢氧根的电子式: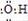 | |
| D. | HClO的结构式:H-O-Cl |
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
 ,I
,I .
. ;D→G
;D→G ;E与新制银氨溶液反应
;E与新制银氨溶液反应 .
.