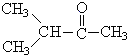
题目内容
19.下列说法正确的是( )| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温条件下一定很容易发生 | |
| C. | 反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 | |
| D. | 吸热反应在常温条件下一定不会发生 |
分析 化学反应过程中一定伴随着能量的改变,主要是由反应物的总能量和生成物的总能量的相对大小决定;当反应物的总能量大于生成物的总能量,反应为放热反应;反之则反之;大多数的放热反应进行时需一定的引发条件才能进行.
解答 解:A.需要加热方能发生的反应不一定是吸热反应,好多放热反应也需要加热如铝热反应,故A错误;
B.放热反应在常温下不一定很容易发生,例如氢气和氧气常温下不会反应,但点燃会瞬间完成,故B错误;
C.反应是吸热还是放热的,取决于反应物和生成物所具有总能量的大小,故C正确;
D.在一定条件下吸热反应也能发生,如铵盐和碱的反应,故D错误;
故选C.
点评 本题考查化学反应的能量变化与反应物的总能量和生成物的总能量有关,难度不大,与放热反应、吸热反应的条件无关.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列物质:①乙烯②乙炔③甲烷④四氯化碳,其中分子具有正四面体型的是( )
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ③④ |
10. 有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
甲同学提出的问题,乙同学解释不正确的是( )
 有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:| 实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑橘 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
| 甲同学 | 乙同学 | |
| A | 实验6中的负极电极反应如何写? | 铝为负极:Al-3e-═Al3+ |
| B | 实验1,5电流方向为什么相反? | 1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
| C | 水果电池的电压与哪些因素有关? | 只跟水果的类型有关 |
| D | 实验中发光二极管不太亮,如何使它更明亮起来? | 可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
| A. | A | B. | B | C. | C | D. | D |
7.下列化学用语正确的是( )
| A. | 氮分子的电子式: | B. | 硫原子的结构示意图: | ||
| C. | 溴化钠的电子式: | D. | 水分子的结构式:H-O-H |
11.下列表达方式正确的是( )
| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 硫离子结构示意图: | |
| C. | 氢氧根的电子式: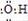 | |
| D. | HClO的结构式:H-O-Cl |
8.下列说法不正确的是( )
| A. | 第二周期中,最高价含氧酸酸性最强的是氟 | |
| B. | 碘的非金属性比氯弱 | |
| C. | VA族中原子半径最小的是氮 | |
| D. | 钠的金属性比锂强 |
9.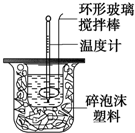 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和氢氧化钠溶液反应表示中和热的热反应化学方程(中和热数值为57.3KJ/mol)NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
①温度差平均值为3.4℃.近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).利用上表数据计算该中和反应的反应热△H=-56.8kJ/mol( 保留一位小数);
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度;
c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和氢氧化钠溶液反应表示中和热的热反应化学方程(中和热数值为57.3KJ/mol)NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度;
c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
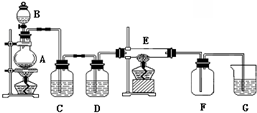
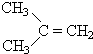 $→_{Zn/H_{2}O_{2}}^{O_{3}}$
$→_{Zn/H_{2}O_{2}}^{O_{3}}$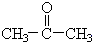 +
+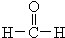 据以上线索和下列反应事实,确定C7H14的结构和名称:C7H14$→_{Zn/H_{2}O_{2}}^{O_{3}}$CH3CHO+
据以上线索和下列反应事实,确定C7H14的结构和名称:C7H14$→_{Zn/H_{2}O_{2}}^{O_{3}}$CH3CHO+