题目内容
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B、沉淀溶解后,生成深蓝色溶液是由于存在配合离子[Cu(NH3)4]2+ |
| C、向反应后的溶液中加入乙醇,将析出深蓝色的晶体CuSO4?5H2O |
| D、在[Cu(NH3)4]2+离子中,既存在离子键,又存在共价键 |
考点:配合物的成键情况
专题:化学键与晶体结构
分析:氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液.
A.硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物;
B.氢氧化铜和氨水反应生成配合物而使溶液澄清;
C.络合物在乙醇中溶解度较小,所以会析出;
D.[Cu(NH3)4]2+离子中没有离子键.
A.硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物;
B.氢氧化铜和氨水反应生成配合物而使溶液澄清;
C.络合物在乙醇中溶解度较小,所以会析出;
D.[Cu(NH3)4]2+离子中没有离子键.
解答:
解:A.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物而使溶液澄清,所以溶液中铜离子浓度减小,故A错误;
B.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物离子[Cu(NH3)4]2+而使溶液澄清,故B正确;
C..[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体,没有CuSO4?5H2O生成,故C错误;
D.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对形成配位键,N与H元素之间形成共价键,没有离子键,故D错误;
故选B.
B.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物离子[Cu(NH3)4]2+而使溶液澄清,故B正确;
C..[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体,没有CuSO4?5H2O生成,故C错误;
D.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对形成配位键,N与H元素之间形成共价键,没有离子键,故D错误;
故选B.
点评:本题考查了配合物、配位键的形成等性质,难度不大,明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、废电池必须集中处理的首要原因是回收其中的各种金属、石墨电极及塑料包装等 |
| B、向煤燃料中加入生石灰,可以减少二氧化硫对大气的污染 |
| C、氟利昂可以破坏臭氧层,从而导致温室效应 |
| D、绿色食品是指使用过化肥和农药生产出来的农副产品 |
在-50℃液氨中有2NH3(液)?NH4++NH2-的电离平衡关系,两离子的平衡浓度均为1×10-15mol/L,下列对-50℃时液氨的表达中正确的是( )
| A、离子积是1×10-15 |
| B、以液氨为溶剂的溶液中C(NH4+)一定等于 C(NH2-) |
| C、若液氨中放人NaNH2,其离于积不变 |
| D、此液氨中放人NH4C1,其离子积数值增加 |
下列有关叙述正确的是( )
| A、高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
| B、实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C、常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D、向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
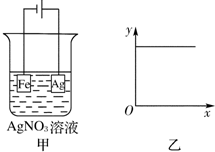 如图所示,按如图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是( )
如图所示,按如图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是( )| A、c(Ag+) |
| B、c(NO3-) |
| C、溶液的pH |
| D、铁片质量 |
某化学反应的△H=-122kJ?mol-1,△S=+231J?mol-1?K-1,则此反应在下列哪种情况下可自发进行( )
| A、在任何温度下都能自发进行 |
| B、在任何温度下都不能自发进行 |
| C、仅在高温下自发进行 |
| D、仅在低温下自发进行 |
下列说法正确的是( )
| A、某种液体的饱和蒸气压与温度有关 |
| B、物体内所有分子热运动动能的总和就是物体的内能 |
| C、气体的温度升高,每个分子的动能都增大 |
| D、不是所有晶体都具有各向异性的特点 |
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A、若增大压强,则物质Y的转化率减小 | ||
B、将容器体积变为20 L,Z的平衡浓度变为原来的
| ||
| C、以X的浓度变化表示的反应速率为0.001 mol/(L?s) | ||
| D、若升高温度,X的体积分数增大,则该反应的△H>0 |
下列离子方程式中书写正确的是( )
| A、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
| B、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+OH-+H+=BaSO4↓+H2O |
| C、澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O |
| D、稀盐酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 |