题目内容
某容积可变的密闭容器中放人一定量的A和B的混合气体,在一定条件下发生反应:A(气)+2B(气)?2C(气).若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积占50%,原混合气体的体积为 V.
考点:化学平衡的计算
专题:化学平衡专题
分析:依据反应特征A(气)+2B(气)?2C(气),反应后气体体积减小,减少的量和反应的A的量相同,分析特征计算得到.
解答:
解:容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:A(气)+2B(气)?2C(气).若维持温度和压强不变,当达到平衡时,容器的体积为V,此时C气体的体积占50%,得到C体积为0.5V,由反应A(气)+2B(气)?2C(气)得到反应A的体积为0.25V,所以根据体积差,反应减小的体积等于A的体积,则原来混合气体的体积=V+0.25V=1.25V,
故答案为:1.25.
故答案为:1.25.
点评:本题考查了化学平衡的计算应用,掌握基础,抓住反应的特征变化是解题的关键,题目难度中等.

练习册系列答案
相关题目
在-50℃液氨中有2NH3(液)?NH4++NH2-的电离平衡关系,两离子的平衡浓度均为1×10-15mol/L,下列对-50℃时液氨的表达中正确的是( )
| A、离子积是1×10-15 |
| B、以液氨为溶剂的溶液中C(NH4+)一定等于 C(NH2-) |
| C、若液氨中放人NaNH2,其离于积不变 |
| D、此液氨中放人NH4C1,其离子积数值增加 |
在一定条件下,对于A2(g)+3B2(g)?2AB3(g)反应来说,下列所表示的化学反应速率中最大的是( )
| A、v(A2)=0.8mol?L-1?s-1 |
| B、v(A2)=40mol?L-1?min-1 |
| C、v(AB3)=1.0mol?L-1?s-1 |
| D、v(B2)=1.2mol?L-1?s-1 |
下列有关叙述正确的是( )
| A、高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
| B、实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C、常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D、向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
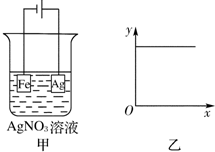 如图所示,按如图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是( )
如图所示,按如图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是( )| A、c(Ag+) |
| B、c(NO3-) |
| C、溶液的pH |
| D、铁片质量 |
下列说法正确的是( )
| A、某种液体的饱和蒸气压与温度有关 |
| B、物体内所有分子热运动动能的总和就是物体的内能 |
| C、气体的温度升高,每个分子的动能都增大 |
| D、不是所有晶体都具有各向异性的特点 |
X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、化合物乙中一定只有共价键 |
| C、W元素是一种亲氧元素 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |