题目内容
12.某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于“0”刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;
向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
⑤重复以上过程.
试回答下列问题:
(1)当滴入最后一滴稀硫酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不改变,可判断达到滴定终点.
(2)滴定过程中,下列会导致滴定结果偏低的是ACE
A、若记录读数时,起始时仰视,终点时俯视
B、滴定前向锥形瓶中加入10mL蒸馏水,其余操作正常
C、若配制硫酸时,定容时俯视刻度,其他操作正常
D、酸式滴定管在装酸液前未用待测硫酸溶液润洗
E、开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失
(3)测定操作中有一步存在问题,该步骤是:第③步(填序号)
(4)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.45 |
| 第二次 | 20.00 | 4.00 | 29.05 |
| 第三次 | 20.00 | 3.00 | 30.00 |
| 第四次 | 20.00 | 2.00 | 27.00 |
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,加入3mL 0.5%淀粉溶液并稀释成250ml溶液,取25ml该溶液,用0.010 0mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为84.00%.(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩尔质量为252g/moL).
分析 (1)滴定终点,溶液从红色变为无色,且半分钟内不改变;
(2)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析不当操作对V(标准)×的影响,以此判断操作误差;
(3)第③步没用硫酸溶液润洗;
(4)第三次实验误差较大,应舍去,根据n(NaOH)V(NaOH)=2n(H2SO4)V(H2SO4)计算;
(5)根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
再由Cr2O72-和6S2O32-的关系式计算Cr2O72-的物质的量,根据原子守恒计算(NH4)2Cr2O7的质量,再根据质量分数公式计算其质量分数即可.
解答 解:(1)氢氧化钠溶液中滴加酚酞呈红色,反应后呈中性,滴定终点,溶液从红色变为无色,且半分钟内不改变,
故答案为:锥形瓶中的溶液从红色变为无色,且半分钟内不改变;
(2)A、若记录读数时,起始时仰视,终点时俯视,导致标准液体积偏小,则测定结果偏小,故A正确;
B、滴定前向锥形瓶中加入10mL蒸馏水,其余操作正常,对实验无影响,故B错误;
C、若配制硫酸时,定容时俯视刻度,其他操作正常,导致硫酸浓度偏大,滴定时需要硫酸体积偏小,则测定结果偏小,故C正确;
D、酸式滴定管在装酸液前未用待测硫酸溶液润洗,导致标准液浓度偏小,则体积偏大,测定结果偏大,故D错误;
E、开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失,氢氧化钠体积偏小,需要硫酸体积偏小,则测定结果偏小,故E正确.
故答案为:ACE;
(3)第③步没用硫酸溶液润洗,会导致标准液浓度偏低,导致实验误差,故答案为:第③步;
(4)第三次实验误差较大,硫酸的体积为$\frac{24.95+25.05+25.00}{3}$mL=25.00mL,
则0.2000mol/L×25.00×10-3L×2=20.00×10-3L×c(NaOH),
c(NaOH)=0.5000mol/L,
故答案为:0.5000;
(5)根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
设Cr2O72-的物质的量为x,
Cr2O72-----6S2O32-,
1 6
x 0.1000mol/L×0.03L
1:6=x:(0.1000mol/L×0.03L)
x=0.0005mol,
根据原子守恒得n(Cr2O72-)=n((NH4)2Cr2O7),则m((NH4)2Cr2O7)=0.0005mol×252g/mol=0.126g,
其质量分数=$\frac{0.126g}{0.150g}$×100%=84.00%,
故答案为:84.00%.
点评 本题考查物质含量的测定以及酸碱中和滴定实验,为高考常见题型和高频考点,侧重于学生的分析、实验和计算能力的考查,题目难度不大,注意把握实验的步骤、方法以及注意事项.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知:H2(g)+F2(g)=2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 KJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
| A. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
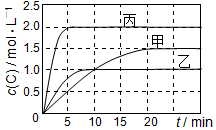 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 平衡后,向甲容器中再充入0.5 mol A,A和B的转化率均增大 | |
| B. | 达到平衡时反应吸收的热量:Q丙>2Q乙 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 在该容器中先投入1molSO3,平衡后再加入1molSO3,达新平衡后SO2的体积分数比原平衡减小 |