题目内容
15.常温下,下列各组离子在溶液一定能大量共存的是( )| A. | I-Fe3+ Na+ | B. | Al3+Ba2+HCO3- | C. | K+Na+CO32- | D. | NH4+K+OH- |
分析 A.铁离子具有氧化性,能够氧化碘离子;
B.铝离子与碳酸氢根离子发生双水解反应;
C.三种离子之间不发生反应,能够共存;
D.铵根离子与氢氧根离子反应生成弱电解质一水合氨.
解答 解:A.I-、Fe3+之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故B错误;
C.K+、Na+、CO32-之间不反应,在溶液中能够大量共存,故C正确;
D.NH4+、OH-之间发生反应,在溶液中不能大量共存,故D错误.
故选C.
点评 本题考查离子共存,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.含NO3-的工业废水会造成水体富营养化,可利用如下反应将其转化为NH3:Al+口+口+口→口+口,反应中涉及到的另外3种微粒是H2O、AlO2-、OH-.下列说法正确的是( )
| A. | 反应中的Al被还原,NO3-是还原剂 | |
| B. | 产物分别是NH3、AlO2-和OH- | |
| C. | 若有4mol Al参加反应,则有1.5mol NO3-被还原 | |
| D. | 随着反应的进行,溶液的碱性逐渐增强 |
6.已知:某元素X的酸式盐(NaHX)溶液显碱性,下列说法正确的是( )
| A. | NaHX的电离方程式为NaHX═Na++H++X2- | |
| B. | HX-的水解程度大于HX-的电离程度 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-) | |
| D. | 离子浓度关系:c(Na+)>c(HX-)+c(H2X)+c(X2-) |
3.化学与生活密切相关,下列有关说法正确的是( )
| A. | 维生素C具有还原性,能在人体内起抗氧化作用 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 糖类是产生能量最高的营养物质 | |
| D. | 废电池必须进行集中处理的首要原因是回收利用石墨电极和金属材料 |
10.结晶玫瑰是一种有机物,它具有强烈的玫瑰香气,是一种很好的定香剂,下列有可能是结晶玫瑰的分子式的是( )
| A. | C10H9Cl3O2 | B. | C10H9Cl2O2 | C. | C10H12Cl3O2 | D. | C10H17Cl3O2 |
7.下列物质中不属于离子化合物的是( )
| A. | NaOH | B. | HCl | C. | Na2O2 | D. | NH4Cl |
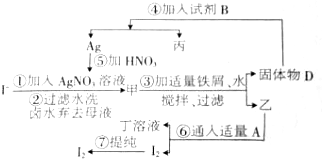 在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用图示的工艺流程生产单质碘:
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用图示的工艺流程生产单质碘: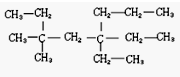
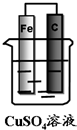 如图装置能否形成原电池?若能,分别写出原电池的电极反应式.
如图装置能否形成原电池?若能,分别写出原电池的电极反应式.