题目内容
14.现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图.请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法.
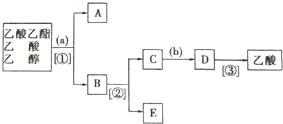
a.饱和Na2CO3溶液;①分液;②蒸馏;b.H2SO4;③蒸馏.
分析 由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,以此来解答.
解答 解:乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,即①为分液.A为乙酸乙酯,B为碳酸钠溶液,吸收乙醇、除去乙酸,对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇,则②为蒸馏.然后C中水层含乙酸钠,根据强酸制弱酸,要用b(浓硫酸)反应得到乙酸,再③蒸馏得到乙酸,
由上述分析可知,试剂a为饱和Na2CO3溶液,b为H2SO4,分离方法①、②、③分别为分液、蒸馏、蒸馏,
故答案为:饱和Na2CO3溶液;分液;蒸馏;H2SO4;蒸馏.
点评 本题考查混合物分离提纯,为高频考点,把握混合物分离流程、分离方法及发生的反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
4.下列关于液氯和氯水的叙述中正确的是( )
| A. | 液氯是纯净物,而氯水是混合物 | B. | 液氯有酸性,氯水有漂白性 | ||
| C. | 液氯较氯水的漂白作用更强 | D. | 液氯无色,氯水呈黄绿色 |
5.由-H、-CH3、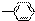 、-OH、-COOH五种原子或原子团中的任意两种,两两组合形成的物质中,溶液显酸性的物质有( )
、-OH、-COOH五种原子或原子团中的任意两种,两两组合形成的物质中,溶液显酸性的物质有( )
 、-OH、-COOH五种原子或原子团中的任意两种,两两组合形成的物质中,溶液显酸性的物质有( )
、-OH、-COOH五种原子或原子团中的任意两种,两两组合形成的物质中,溶液显酸性的物质有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
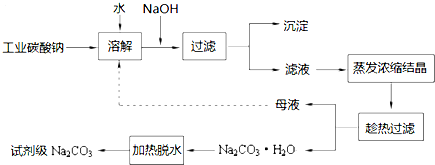
9.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质.为了提纯工业碳酸钠,并获得试剂级碳酸钠,采取工艺流程如图所示:
已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
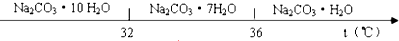
Ⅱ.有关物质的溶度积如下
(1)加入NaOH溶液主要为了除去Mg2+(填离子符号),发生反应的离子方程式为MgCO3+2OH-=Mg(OH)2+CO32-、Mg2++2OH-=Mg(OH)2↓;“沉淀”的主要成份有Mg(OH)2、Fe(OH)3、CaCO3(填化学式);
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021.
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73KJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.

已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
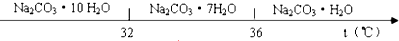
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021.
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73KJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.
6.下列说法正确的是( )
| A. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 | |
| C. | 元素周期律是元素原子核外电子排布周期性变化的结果 | |
| D. | 形成离子键的阴、阳离子间只存在静电吸引力 |
3.不法分子将毒品伪装成咖啡、麦片、面膜等贩卖到世界各地,已知部分毒品的结构简式如图,下列对毒品分类正确的是( )
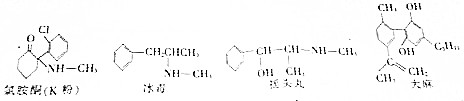

| A. | 盐 | B. | 氧化物 | C. | 有机物 | D. | 油脂 |
 .
.