题目内容
9.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质.为了提纯工业碳酸钠,并获得试剂级碳酸钠,采取工艺流程如图所示: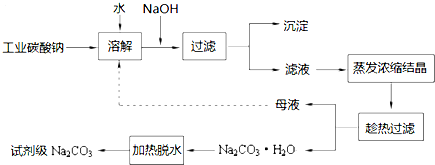
已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
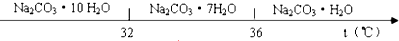
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021.
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73KJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.
分析 工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、和Cl-、SO42ˉ等杂质,加入水溶解后加入氢氧化钠溶液过滤得到滤液通过蒸发浓缩,冷却结晶,趁热过滤得到碳酸钠晶体,加热脱水得到实际级碳酸钠,母液重新溶解循环使用;
(1)因工业碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀;
(2)根据碳酸钠溶液中碳酸根离子的水解是吸热反应判断;
(3)使析出的晶体为Na2CO3•H2O,防止因温度过低而析出Na2CO3•10H20晶体或Na2CO3•7H20晶体,36℃是一个转折点;
(4)通过观察两个热化学方程式,利用盖斯定律来计算焓变即可;
(5)分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响.
解答 解:(1)碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀,主要是除去镁离子,滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3,发生的发应有:Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg (OH) 2↓+CO32-,Mg2++2OH-=Mg (OH) 2↓,当两种沉淀共存且溶液的pH=8时,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-8}}$=10-6mol/L;
c(Mg2+):c(Fe3+)=$\frac{Ksp(Mg(OH)_{2})}{{c}^{2}(O{H}^{-})}$:$\frac{Ksp(Fe(OH)_{3})}{{c}^{3}(O{H}^{-})}$=$\frac{5.61×1{0}^{-12}}{(1{0}^{-8})^{2}}$:$\frac{2.64×1{0}^{-39}}{(1{0}^{-8})^{3}}$=2.125×1021;
故答案为:Mg2+;MgCO3+2OH-=Mg(OH )2↓+CO32-; Mg2++2OH-=Mg (OH) 2↓;Mg(OH)2、Fe(OH)3、CaCO3;2.125×1021;
(2)热的Na2CO3溶液有较强的去油污能力,是由于Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强,
故答案为:Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强;
(3)“趁热过滤”的原因是使析出的晶体为Na2CO3•H2O,防止因温度过低而析出Na2CO3•10H20晶体或Na2CO3•7H20晶体,所以温度高于36℃,
故答案为:高于36℃;
(4)通过观察两个热化学方程式,利用盖斯定律,可将两式相减得到Na2CO3•H2O(S)═Na2CO3(s)+H2O(g),
即Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol,
故答案为:Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol;
(5)若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质,这样不符合该提纯工艺,
故答案为:不可行;若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.
点评 本题考查了物质的分离、提纯及物质的制取等知识,题目难度中等,本题是一道比较综合的试题题,有利于考查学生分析和解决问题的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 检验某有机物中是否含有醛基:取少量水溶液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,看是否有砖红色沉淀生成 | |
| B. | 提纯混有少量CaCl2的NaCl固体:将固体配成溶液,加入稍过量Na2CO3溶液至沉淀完全,过滤,再向滤液中加入稍过量盐酸,蒸发结晶 | |
| C. | 验证某无色溶液中存在SO42-:向试管中加入少量待测溶液,然后加入少量BaCl2溶液,后加入足量稀硝酸,观察到最后仍有白色沉淀生成即可 | |
| D. | 验证炭与浓硫酸反应产生的CO2:将炭与浓硫酸反应生成的气体通入盛有澄清石灰水的试管中,观察是否有白色沉淀生成 |
| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定含有丙烯 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |
| A. | PCl3 | B. | NaH | C. | NO2 | D. | SF6 |
| A. | NH3 | B. | SO3 | C. | HF | D. | H2O |
| A. | 绿色食品是指不含任何化学物质的食品 | |
| B. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 生物固氮是指植物通过叶面直接吸收空气中的氮气 |

| A. | ①、②反应依次为加成反应、取代反应 | |
| B. | 上述三种有机物的含氧官能团完全相同 | |
| C. | 青蒿素因含酯基具有氧化性和杀菌功能 | |
| D. | 蒿甲醚的化学式为C16H24O5 |
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、H+和H2是氢元素的四种不同粒子 | |
| B. | ${\;}_{20}^{40}$Ca和 ${\;}_{20}^{42}$Ca、石墨和金刚石均为同位素 | |
| C. | ${\;}_{1}^{1}$H和 ${\;}_{1}^{2}$H是不同的核素 | |
| D. | 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同 |