题目内容
19.将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一,已知:TiO2(s)+2Cl2(g)═TiCl4(1)+O2(g)△H=+140.5kJ/mol
C(s,石墨)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)═TiCl4(1)+2CO(g)的△H=-80.5kJ/mol.
分析 根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式,据此计算.
解答 解:已知:①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+140.5kJ/mol
②C(s,石墨)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
根据盖斯定律,①+②×2得TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g);△H=+140.5kJ/mol+(-110.5kJ/mol)×2=-80.5kJ/mol,
故答案为:-80.5.
点评 本题考查盖斯定律、反应热的计算,题目难度中等,理解盖斯定律并利用已知热化学方程式进行叠加构造目标热化学方程式是关键,试题培养了学生的化学计算能力.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
9.向HNO3和BaCl2的混合溶液中通入SO2,有白色沉淀生成,此沉淀为( )
| A. | FeS | B. | BaSO3 | C. | BaSO4 | D. | S |
10.下列5个转化,其中不能通过一步反应实现的是( )
①SiO2→Na2SiO3 ②Fe(OH)2→Fe(OH)3 ③SiO2→H2SiO3 ④Al2O3→Al(OH)3 ⑤Na2O2→NaCl.
①SiO2→Na2SiO3 ②Fe(OH)2→Fe(OH)3 ③SiO2→H2SiO3 ④Al2O3→Al(OH)3 ⑤Na2O2→NaCl.
| A. | ①② | B. | ③④ | C. | ③④⑤ | D. | ①⑤ |
4.下列有关反应速率的叙述中,不正确的是( )
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 反应物的性质是决定反应速率快慢的主要因素 | |
| C. | 相同体积、不同浓度的盐酸分别与大小、形状都相同的铁片反应的速率:1 mol•L-1时<0.1 mol•L-1时 | |
| D. | 在不同温度时,鲜牛奶变酸的速率:28℃时>5℃时 |
11.可用于鉴别以下三种化合物的一组试剂是( )

①银氨溶液
②溴的四氯化碳溶液
③氯化铁溶液
④氢氧化钠溶液.

①银氨溶液
②溴的四氯化碳溶液
③氯化铁溶液
④氢氧化钠溶液.
| A. | ②与③ | B. | ③与④ | C. | ①与④ | D. | ①与② |
4.将铁屑溶于过量的稀盐酸后,再加入下列物质,溶液中铁元素只以Fe2+存在的是( )
| A. | 氯水 | B. | 稀硫酸 | C. | KMnO4溶液 | D. | 双氧水 |
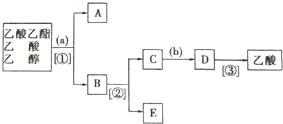
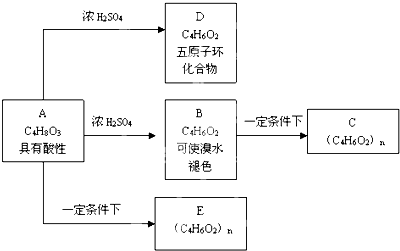
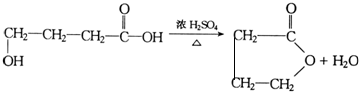

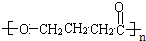 +nH2O
+nH2O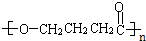 ;
;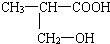 及
及 .
.