题目内容
1.氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、极易水解,可用作肥料、灭火剂、洗涤剂等.实验室用如图1所示装置制备氨基甲酸铵.把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中.当悬浮物较多时,停止制备.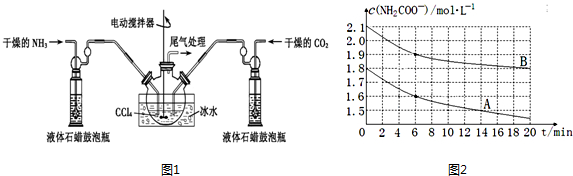
(1)结合上述实验装置,写出制备氨基甲酸胺的化学方程式2NH3(g)+CO2(g)?NH2COONH4,该反应为放热反应(填“吸热”或“放热”).
(2)液体石蜡鼓泡瓶的作用是通过观察气泡,控制气体流速和调节NH3与CO2通入比例.
(3)从反应后的混合物中分离出产品的实验方法是过滤.
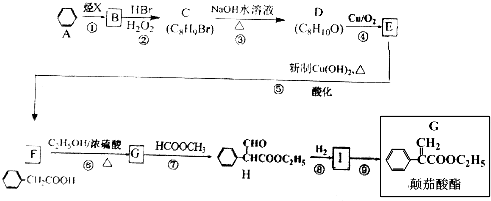
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱酸,请写出其水分解反应方程式NH2COONH4+2H2O?NH4HCO3+NH3•H2O.某学习小组为探究其水解反应,分别取两份不同浓度的氨基甲酸胺溶液,绘制出c(NH2COO-)随时间(t)变化曲线如图2所示,若A、B分别为不同温度时测定的曲线,则A(“A”或“B”)曲线所对应的实验温度高,判断的依据是6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行.
(5)制得的氨基甲酸胺可能含有碳酸氢铵.取某氨基甲酸胺样品4.69g,用足量氢氧化钡溶液充分处理后,使碳元素完全转化为碳酸钡、过滤、洗涤、干燥,测得沉淀质量为11.82g.则样品中氨基甲酸胺的物质的量分数为83.3%.
分析 (1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4;氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应;
(2)根据液体石蜡瓶鼓泡瓶中气泡控制气体流速和原料气体的配比;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O;水解反应为吸热反应,升高温度有利于水解进行,对比6~20min内c(NH2CCOO-)变化量越大,水解程度越大,温度越高;
(5)生成的沉淀为碳酸钡,根据碳原子守恒、混合物总质量列方程各自物质的量,再计算氨基甲酸胺的质量,进而计算其物质的量分数.
解答 解:(1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4,反应方程式为:2NH3(g)+CO2(g)?NH2COONH4,
氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应,
故答案为:2NH3(g)+CO2(g)?NH2COONH4;放热;
(2)可以根据液体石蜡瓶鼓泡瓶中气泡,控制气体流速和调节NH3与CO2通入比例,
故答案为:通过观察气泡,控制气体流速和调节NH3与CO2通入比例;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离,
故答案为:过滤;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O,反应方程式为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;
6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行,故曲线A的温度高于曲线B的,
故答案为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;A;6~20min内曲线A中c(NH2CCOO-)减小量大于曲线B的,水解反应为吸热反应,升高温度有利于水解进行;
(5)生成的沉淀为碳酸钡,其物质的量为:$\frac{11.82g}{197g/mol}$=0.06mol,
氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,
由碳元素守恒可知:x+y=0.06
由质量可得:78x+79y=4.69
解得x=0.05mol,y=0.01mol,
则制得的样品中氨基甲酸胺的物质的量分数为:$\frac{0.05mol}{0.06mol}$×100=83.3%,
故答案为:83.3%.
点评 本题考查物质制备实验、化学反应速率影响因素、物质含量测定、化学与技术等,题目难度中等,把握反应原理为解答的关键,侧重分析与实验能力的考查,综合性较强.


(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除去杂质、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2 mol•L-1 HCl、1 mol•L-1 H2SO4、0.1 mol•L-1 NaOH、0.1 mol•L-1BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
| A. | 漂白粉既可作纸张的漂白剂,又可用作游泳池的消毒剂 | |
| B. | 汽车尾气中含有氮的氧化物,是由汽油不完全燃烧造成的 | |
| C. | 氧化铝、氢氧化钠、碳酸氢钠都是常见的胃酸中和剂 | |
| D. | 工业上,焦炭在高温下还原二氧化硅得到粗硅,说明碳的金属性比硅的强 |
| 选项 | 待提纯的物质 | 选用试剂 | 操作的方法 |
| A | FeCl3溶液(FeCl2溶液) | 铜粉 | 过滤 |
| B | CO2(SO2) | NaHCO3溶液 | 洗气 |
| C | HCl(Cl2) | 饱和食盐水 | 洗气 |
| D | NH4Cl固体(I2固体) | -- | 加热至质量不再变化 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | 金属、非金属、稀有气体 | B. | 化合物、盐、酸式盐 | ||
| C. | 碱、碱性氧化物、碱式盐 | D. | 混合物、化合物、纯净物 |
| A. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| B. | 在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶中,取出坩埚钳,盖上玻璃片,观察Mg条在集气瓶底部燃烧 | |
| C. | 为比较Cl与S元素非金属性强弱,相同条件下测定相同浓度NaCl溶液和Na2S溶液的pH值 | |
| D. | 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水 |
 ;
;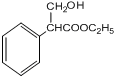 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$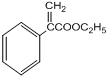 +H2O;
+H2O;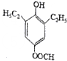 、
、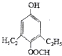
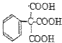 的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.