题目内容
20.下列有关说法中,正确的是( )| A. | 焰火的五彩缤纷是某些金属元素化学性质的体现 | |
| B. | 高纯度的单晶硅用于制造登月车的光电池和光导纤维 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 用明矾可以将自来水净化成纯净水 |
分析 A.焰色反应为元素的物理性质;
B.光导纤维主要成分是二氧化硅;
C.铜离子属于重金属离子,可以使蛋白质变性;
D.明矾只能除去水中悬浮的杂质.
解答 解:A.焰火的五彩缤纷是利用不同金属灼烧产生不同焰色的性质,属于元素的物理性质,故A错误;
B.光导纤维主要成分是二氧化硅,不是硅,故B错误;
C.可溶性铜盐中含有重金属离子铜离子,重金属离子可以使蛋白质变性,所以说可溶性铜盐有毒;铜与人体健康有着密切的关系,铜是人体健康内一种必需的微量元素,在人体的新陈代谢过程中起着重要的作用,故C正确;
D.明矾只能除去水中悬浮的杂质,不能除去水中的离子,故D错误.
故选:C.
点评 本题考查了化学与生产和生活关系,熟悉硅及二氧化硅的性质和用途、明矾净水原理、化学变化与物理变化的区别是解题关键,题目难度不大,注意焰色反应为元素性质.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
8.生活与化学紧密联系,以下说法正确的是( )
| A. | 在医疗上碳酸钠可用于治疗胃酸过多 | |
| B. | 家用铁锅用水清洗后置于干燥处,能减缓电化学腐蚀 | |
| C. | 清洁能源所用光电池的生产材料主要是高纯度的二氧化硅 | |
| D. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
15.化学与生产、生活、社会密切相关.下列说法正确的是( )
| A. | 长期放置的漂白粉是因与空气中的氧气发生反应而变质 | |
| B. | 粗硅提纯是利用H2作还原剂,将硅从其氯化物中还原出来 | |
| C. | 利用半透膜除去海水中的NaCl、MgCl2等离子化合物可获得淡水 | |
| D. | 工业上用铝热反应来冶炼Fe、Cr、Mn、V等稀有金属 |
5.下列说法不正确的是( )
| A. | 分子式为C5H12的化合物,其一氯代物种类(不考虑立体异构)不可能是2种 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| D. | 石油裂化、油脂皂化和煤的干馏都是化学变化,而石油的分馏和蛋白质的盐析都是物理变化 |
12.某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子.某小组在实验室中用浸出萃取法制备硫酸铜:

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除去杂质、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2 mol•L-1 HCl、1 mol•L-1 H2SO4、0.1 mol•L-1 NaOH、0.1 mol•L-1BaCl2、蒸馏水.仪器和用品自选.
(4)上述实验需要100 mL 0.5 mol•L-1的CuSO4溶液,配制时需称取12.5g CuSO4•5H2O(化学式量:250).

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除去杂质、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2 mol•L-1 HCl、1 mol•L-1 H2SO4、0.1 mol•L-1 NaOH、0.1 mol•L-1BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
9.化学在生产和生活中有着重要的应用,下列叙述中正确的是( )
| A. | 漂白粉既可作纸张的漂白剂,又可用作游泳池的消毒剂 | |
| B. | 汽车尾气中含有氮的氧化物,是由汽油不完全燃烧造成的 | |
| C. | 氧化铝、氢氧化钠、碳酸氢钠都是常见的胃酸中和剂 | |
| D. | 工业上,焦炭在高温下还原二氧化硅得到粗硅,说明碳的金属性比硅的强 |
10.为达到相应的实验目的,下列实验的设计或操作最合理的是( )
| A. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| B. | 在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶中,取出坩埚钳,盖上玻璃片,观察Mg条在集气瓶底部燃烧 | |
| C. | 为比较Cl与S元素非金属性强弱,相同条件下测定相同浓度NaCl溶液和Na2S溶液的pH值 | |
| D. | 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水 |
 ;
;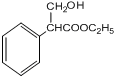 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$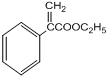 +H2O;
+H2O;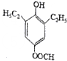 、
、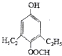
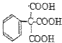 的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.