题目内容
16.恒温恒容的密闭容器中发生如下反应:2A(g)+B(s)?C(g)+D(g),当下列物理量不再发生变化时:①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④C的物质的量浓度,上述反应一定达到平衡状态的是( )| A. | ②③ | B. | ②④ | C. | ②③④ | D. | ①③④ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解::①混合气体的密度,说明气体的质量不变,反应达平衡状态,故正确;
②两边计量数相等,容器内气体的压强始终不变,故错误;
③混合气体的平均相对分子质量说明气体的质量不变,反应达平衡状态,故正确;
④C的物质的量浓度,正逆反应速率相等,反应达到平衡状态,故正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
6.关于裂解和裂化的叙述中,不正确的是( )
| A. | 裂解与裂化的产物都含有不饱和烃 | |
| B. | 裂解与裂化都是烃的分解反应 | |
| C. | 裂解与裂化的原料都是石油分馏产品 | |
| D. | 裂解与裂化都是为得到气态烃 |
7.下列有关化学用语表示正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | 16O2-和18O2-的结构示意图: | ||
| C. | 氮气的电子式: | D. | 电子式表示氯化钠的形成过程: |
4.下列离子在溶液中能大量共存的是( )
| A. | NH4+、SO42-、NO3-、H+ | B. | NO3、H+、Fe2+、Cl- | ||
| C. | NH4+、Cl-、OH-、NO3- | D. | I-、NO3-、Fe3+、Na+ |
11.下列实验操作中,不正确的是( )
| A. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体直接放入容量瓶中溶解 | |
| B. | 蒸馏时,冷却水从冷凝管的下口通入,上口流出 | |
| C. | 用分液漏斗分液时,下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用四氯化碳萃取碘水中的碘单质 |
8.某原子核外M层上的电子数是K层电子数的三倍,则该元素的核电荷数为(( )
| A. | 14 | B. | 8 | C. | 16 | D. | 12 |
5.常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入石蕊溶液,出现红色,该溶液可能是( )
| A. | pH=12的Ba(OH)2 | B. | pH=12的氨水 | ||
| C. | 0.02mol•L-1的NaOH | D. | 0.01mol•L-1的BaCl2 |
6.某酸性工业废水,可能含有Fe3+、Fe2+、Cu2+、Ca2+、Cl-、NO3-、Br-、I-中的一种或几种,为了能回收其中的某些成分,进行了以下实验: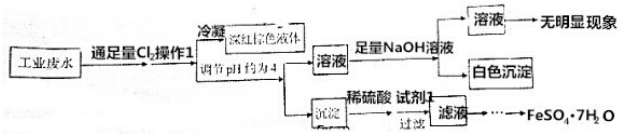
已知pH=4时,Fe3+沉淀完全,而Cu2+、Ca2+未沉淀.
下列说法不正确的是( )

已知pH=4时,Fe3+沉淀完全,而Cu2+、Ca2+未沉淀.
下列说法不正确的是( )
| A. | 该工业废水中肯定存在Cu2+、I- | |
| B. | 若废水中存在NO3-,则肯定存在Fe3+ | |
| C. | 操作1为鼓入热空气,试剂1为Fe | |
| D. | 为了得到FeSO4•7H2O,需要经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥 |