题目内容
9.下列叙述不正确的是( )| A. | 10mL质量分数为98%的H2SO4用10mL水稀释后;H2SO4的质量分数大于49% | |
| B. | 在标准状况下,将11.2 L氨气溶于500mL水中,得到1mol•L-1的氨水 | |
| C. | 配制0.1 mol•L-1的Na2CO3溶液480mL,需用500ml容量瓶 | |
| D. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
分析 A.硫酸的密度大于水的密度;
B.溶液的体积不等于水的体积;
C.实验室中没有480mL的容量瓶,需用500ml容量瓶;
D.等物质的量的过氧化钠、氧化钠与水反应生成氢氧化钠的物质的量相等.
解答 解:A.硫酸的密度大于水,10mL质量分数为98%的H2SO4的质量大于10mL水,混合液质量小于原硫酸溶液质量的2倍,则混合液中H2SO4的质量分数大于49%,故A正确;
B.标准状况下22.4L氨气的物质的量为1mol,将1mol氨气溶于1L水中,所带溶液的体积不是1L,得到溶液浓度不是1mol•L-1,故B错误;
C.配制0.1mol•L-1的Na2CO3溶液480mL,应该选用规格稍大于该体积且规格比较接近的容量瓶,所以配制时需要需用500mL容量瓶,故C正确;
D.向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,由于等物质的量的过氧化钠、氧化钠与水反应生成的氢氧化钠的量相等,所以使溶液均恰好饱和时加入的Na2O2与Na2O的物质的量之比等于1:1(温度不变),故D正确;
故选B.
点评 本题考查了物质的量浓度的计算、配制一定浓度的溶液方法、过氧化钠与氧化钠的性质,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力及对基础知识的把握情况,注意熟练掌握物质的量浓度的概念及计算方法.

练习册系列答案
相关题目
20.下列有关气体摩尔体积的描述中正确的是( )
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 通常状况(室温、101kP)下,气体摩尔体积约为22.4L/mol | |
| C. | 标准状况(0℃、101kP)下,气体摩尔体积约为22.4 L | |
| D. | 标准状况(0℃、101kP)下,1 mol H2O的体积是22.4 L |
14.下列有关化学用语及其叙述,不正确的是( )
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{14}$C互为同位素 | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | 氟离子结构示意图: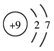 | D. | -OH的电子式: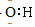 |
1.某小组同学用如下装置电解食盐水,并对电解产物进行探究.
资料显示:
①氯化亚铜(CuCl)为白色粉末,微溶于水;
②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O;
③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu;
④氢氧化铜可以溶于浓NaOH得到蓝色溶液.
(1)经检验,b极产生的气体是H2,b极附近溶液的pH增大(填“增大”、“减小”、或“不变”);铜丝a应与电源的正(填“正”或“负”)极相连.
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为Cu+.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
①氯化亚铜(CuCl)为白色粉末,微溶于水;
②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O;
③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu;
④氢氧化铜可以溶于浓NaOH得到蓝色溶液.
(1)经检验,b极产生的气体是H2,b极附近溶液的pH增大(填“增大”、“减小”、或“不变”);铜丝a应与电源的正(填“正”或“负”)极相连.
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为Cu+.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.
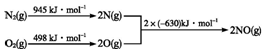
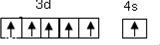 .
. .
.