题目内容
12.某化工厂以软锰矿、闪锌矿(主要成分为MnO2、ZnS,还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,可得到含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液,其中发生的主要反应之一如下,请配平此反应方程式:3MnO2+2FeS+6H2SO4=3MnSO4+1Fe2(SO4)3+2S+6H2O
(2)将所得溶液按以下的工业流程(如图I)进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.
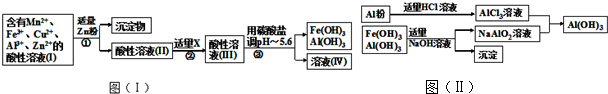
a.操作①中加Zn粉后发生反应的离子方程式为Zn+Cu2+=Zn2++Cu;Zn+2Fe3+=Zn2++2Fe2+;
b.操作②中加入适量X的作用是将Fe2+氧化成Fe3+;
c.工业上用惰性电极电解溶液(IV)获得产品,请写出电解过程中的阳极反应式Mn2+-2e-+2H2O=Mn+4H+;
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程如图(Ⅱ).
a.AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;
b.若得到n molAl(OH)3,则理论上消耗的NaOH和HCl的物质的量分别为$\frac{3n}{4}$mol、$\frac{3n}{4}$mol.
分析 (1)反应中锰元素化合价从+4价降为+2价,硫化亚铁中二价铁化合价升高为三价铁离子,-2价的硫化合价升高为单质硫中的0价,依据氧化还原反应得失电子守恒配平方程式;
(2)a.锌可以Cu2+和Fe3+反应;
b.MnO2可将Fe2+氧化成Fe3+;
c.溶液(IV)为氯化锌、氯化锰溶液,用惰性电极电解,阳极二价锰离子失去电子发生氧化反应,结合水生成氧化锰;
(3)a.AlCl3溶液和NaAlO2溶液发生双水解反应反应生成AI(OH)3;
b.由方程式可知生成4molAI(OH)3需要1molAl3+和3molAlO2-;
解答 解:(1)反应中锰元素化合价从+4价降为+2价,硫化亚铁中二价铁化合价升高为三价铁离子,-2价的硫化合价升高为单质硫中的0价,要使反应中得失电子守恒,则二氧化锰系数为3,硫化亚铁系数为2,依据原子个数守恒可知反应方程式为:3MnO2+2FeS+6H2SO4=3MnSO4+Fe2(SO4)3+2S↓+6H2O;
故答案为:3,2,6,3,1,2,6;
(2)a.锌可以Cu2+和Fe3+反应,方程式为:Zn+Cu2+=Zn2++Cu; Zn+2Fe3+=Zn2++2Fe2+,
故答案为:Zn+Cu2+=Zn2++Cu; Zn+2Fe3+=Zn2++2Fe2+;
b.X是MnO2,MnO2可将Fe2+氧化成Fe3+,便于通过调节pH值除去三价铁离子;
故答案为:将Fe2+氧化成Fe3+;
c.溶液(IV)为氯化锌、氯化锰溶液,用惰性电极电解,阳极二价锰离子失去电子发生氧化反应,结合水生成氧化锰,电解反应式为:Mn2+-2e-+2H2O=Mn+4H+;
故答案为:Mn2+-2e-+2H2O=Mn+4H+;
(3)a.AlCl3溶液和NaAlO2溶液发生双水解反应反应生成AI(OH)3,离子方程式:Al3++3AlO2-+6H2O=4Al(OH)3↓;
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
b.由方程式Al3++3AlO2-+6H2O=4Al(OH)3↓;可知生成4molAl(OH)3需要1molAl3+和3molAlO2-,即由铝单质生成1molAl3+需要3mol盐酸和由氢氧化铝与氢氧化钠反应生成3molAlO2-需要3mol氢氧化钠,即消耗的NaOH和HCl的理论量(mol)都为$\frac{3n}{4}$mol,
故答案为:$\frac{3n}{4}$mol;$\frac{3n}{4}$mol;
点评 本题为综合题,考查了氧化还原反应方程式的配平,物质的分离和提纯,明确氧化还原反应规律,准确把握离子方程式书写方法是解题关键,题目难度中等.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | 酒精与水 | B. | 汽油与植物油 | C. | 溴与四氯化碳 | D. | 水与四氯化碳 |
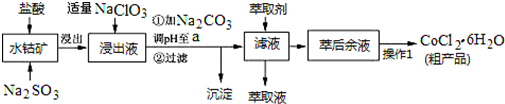
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
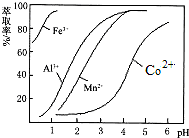
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
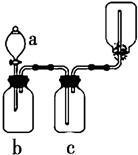 下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )
下图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是 ( )| 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | 碳酸钙 | 浓硫酸 |
| A. | A | B. | B | ||
| C. | C D.D |
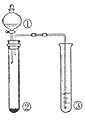 利用如图所示装置进行下列实验,能得出相应实验结论的是( )
利用如图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | Na2S | CuSO4 | 酸性:H2S>H2SO4 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
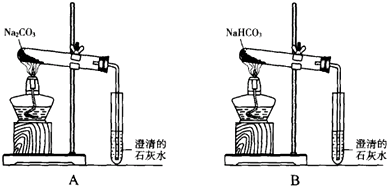
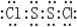 .Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl
.Y2 Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl