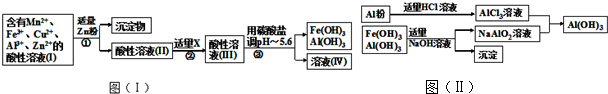
题目内容
20.(1)计算0.5mol CO2的质量是22g,约含有3.01×1023个CO2分子; 计算1.204×1024个H2O分子的物质的量是2mol,质量是36g.(2)100mL 5mol/LNa2CO3溶液中所含Na2CO3的物质的量是0.5mol,Na2CO3的质量53g.
(3)1mol H2SO4中含1mol硫原子,1.204×1024个氢原子.
分析 (1)根据m=nM计算二氧化碳质量,根据N=nNA计算二氧化碳分子数目;根据n=$\frac{N}{{N}_{A}}$计算水的物质的量,再根据m=nM计算水的质量;
(2)根据n=cV计算Na2CO3的物质的量,再根据m=nM计算Na2CO3的质量;
(3)硫酸分子中含有硫原子物质的量等于硫酸的物质的量,还原H原子物质的量为硫酸的2倍,根据N=nNA计算含有氢原子数目.
解答 解:(1)0.5mol CO2的质量是0.5mol×44g/mol=22g,约含有CO2分子数目为0.5mol×6.02×1023mol-1=3.01×1023,
1.204×1024个H2O分子的物质的量是$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,质量是2mol×18g/mol=36g,
故答案为:22g;3.01×1023;2mol;36g;
(2)100mL 5mol/LNa2CO3溶液中所含Na2CO3的物质的量是0.1L×5mol/L=0.5mol,Na2CO3的质量是0.5mol×106g/mol=53g,
故答案为:0.5mol;53g;
(3)1mol H2SO4中含硫原子为1mol×1=1mol,含有氢原子数目为1mol×2×6.02×1023mol-1=3.01×1023=1.204×1024,
故答案为:1;1.204×1024.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心计算,有利于基础知识的巩固.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
19.C60自被发现以来,已逐步应用到超导、材料等各个领域.下列有关说法正确的是( )
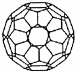

| A. | C60就是金刚石 | B. | C60属于有机化合物 | ||
| C. | C60的摩尔质量是720g/mol | D. | 1mol C60完全燃烧生成22.4L CO2 |
20.人们对未发现的第114号元素很感兴趣,预测它有良好的力学、光学、电学性质,它被命名为“类铅”.以下对“类铅”的叙述正确的是( )
| A. | 最外层有6个电子 | B. | 位于元素周期表的第七周期 | ||
| C. | 主要化合价为-4价、+4价 | D. | “类铅”不能和盐酸反应放出氢气 |
5.下列事实不能证明HNO2是弱酸的是( )
| A. | 向HNO2溶液中加入NaNO2固体,pH变大 | |
| B. | 用HNO2溶液做导电性实验,灯泡很暗 | |
| C. | 0.1mol•L-1的HNO2溶液的pH=2 | |
| D. | pH=3的HNO2溶液稀释至100倍后,3<pH<5 |
9. I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:
(1)E原子的外围电子排布式为2s22p5.
(2)与AD2互为等电子体的分子化学式为N2O(写出一种).
(3)BD2分子中B原子的杂化方式为sp2杂化,分子的立体构型为V形.
Ⅱ.下表是部分金属元素的电离能.
(4)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物( RCl)的熔点由低到高的顺序为ZCl<YCl<XCl.
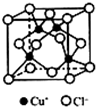
(5)氯化亚铜常用作有机合成催化剂,并用于颜料,防腐等工业.氯化亚铜的晶体结构如图所示.与同一个Cl-相连的Cu+有4个.若晶胞的边长为a cm,则该品体的密度为$\frac{398}{{N}_{A}×{a}^{3}}$g•cm-3.(设NA为阿伏加德罗常数的值)
 I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
(2)与AD2互为等电子体的分子化学式为N2O(写出一种).
(3)BD2分子中B原子的杂化方式为sp2杂化,分子的立体构型为V形.
Ⅱ.下表是部分金属元素的电离能.
| X | Y | Z | |
| 第一电离能/(kJ/mol) | 520.2 | 495.8 | 418.8 |
(5)氯化亚铜常用作有机合成催化剂,并用于颜料,防腐等工业.氯化亚铜的晶体结构如图所示.与同一个Cl-相连的Cu+有4个.若晶胞的边长为a cm,则该品体的密度为$\frac{398}{{N}_{A}×{a}^{3}}$g•cm-3.(设NA为阿伏加德罗常数的值)