题目内容
12.发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃刹.(1)已知:2N2H4(1)+N2O4(1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1
断开1mol下列化学键吸收的能量分别为:N-H:391kJ;N-N:193kJ;N≡N:946kJ;O-H:463kJ.
则使1molN2O4(1)分子中化学键完全断裂时需要吸收的能量是1803KJ.
(2)t℃时,将一定量的NO2(g)和N2O4(g)充入一个容积为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
| 时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②前10min内用NO2表示的反应速率为0.04mol/(L•min),20min时改变的条件是增大NO2的浓度(或向容器中加入0.8mol二氧化氮);重新达到平衡时,NO2的百分含量与原平衡状态相比B(填序号)
A.增大 B.减小 C.不变 D.无法判断
(3)肼的性质与氨相似,其水溶液显弱碱性.请用电离方程式表示肼的水溶液显碱性的原因:N2H4+H2O?N2H+5+OH-.肼与氧气构成的燃料电池在碱性条件下放电时,生成水与一种无污染的气体.放电时,该电池负极的电极反应式为N2H4+4OH--4e-=4H2O+N2.
(4)已知在相同条件下N2H4•H2O的电离程度大于N2H5Cl的水解程度.常温下,若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
分析 (1)反应热=反应物总键能-生成物总键能,根据2N2H4(1)+N2O4(1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1计算;
(2)①X、Y的起始浓度分别为0.2mol/L、0.6mol/L,前10min内,X浓度增大了0.4mol/L、Y的浓度减小0.2mol/L,由于NO2、N2O4与按物质的量2:1反应,则X为NO2、Y为N2O4;平衡常数K=$\frac{{C}^{2}(N{O}_{2})}{C({N}_{2}{O}_{4})}$,代入物质的浓度计算;
②根据v=$\frac{△c}{△t}$计算v(NO2);20min时,Y(N2O4)的浓度不变,X(NO2)的浓度增大,改变的条件应是增大NO2的浓度,等效为增大压强,平衡向生成N2O4的向逆反应进行,减少2molNO2的同时混合气体总物质的量减小1mol,则混合气体中NO2的百分含量减小;
(3)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子;肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,正极上氧气得电子和水反应生成氢氧根离子;
(4)若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,得到物质的浓度相等N2H5C1和N2H4•H2O,而在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度,所以离子浓度大小为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+),由此解答.
解答 解:(1)设1mol N2O4(1)完全分解成相应的原子时需要吸收的能量QKJ,2N2H4(1)+N2O4(1)═3N2(g)+4H2O(1)△H=-1225kJ•mol-1,则:
193kJ/mol×2+391kJ/mol×8+QkJ/mol-946kJ/mol×3-463kJ/mol×8=-1225 kJ/mol,解得Q=1803,
故答案为:1803kJ;
(2)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,X、Y的起始浓度分别为0.2mol/L、0.6mol/L,10min时到达平衡,X浓度增大了0.4mol/L、Y的浓度减小0.2mol/L,由于NO2、N2O4与按物质的量2:1反应,则X为NO2、Y为N2O4,平衡常数K=$\frac{{C}^{2}(N{O}_{2})}{C({N}_{2}{O}_{4})}$=$\frac{0.{6}^{2}}{0.4}$=0.9,
故答案为:NO2;0.9;
②v(NO2)=$\frac{0.6mol/L-0.2mol/L}{10min}$=0.04mol/(L•min);20min时,Y(N2O4)的浓度不变,X(NO2)的浓度增大,改变的条件应是增大NO2的浓度(或向容器中加入0.8mol二氧化氮),等效为增大压强,平衡向生成N2O4的向逆反应进行,减少2molNO2的同时混合气体总物质的量减小1mol,则混合气体中NO2的百分含量减小,
故答案为:0.04mol/(L•min);增大NO2的浓度(或向容器中加入0.8mol二氧化氮);B;
(3)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O?N2H+5+OH-,肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,电极反应式为N2H4+4OH--4e-=4H2O+N2,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:N2H4+H2O?N2H+5+OH-;N2H4+4OH--4e-=4H2O+N2;
(4)若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,得到物质的浓度相等N2H5C1和N2H4•H2O,而在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度,所以离子浓度大小为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查反应热的计算、化学平衡常数的计算、化学平衡影响移动、电化学知识、溶液中离子浓度的比较等,是对学生综合能力的考查,电极反应式的书写,明确各个电极上发生的反应是解答关键,离子浓度大小比较注意相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度,题目难度中等.

①单位时间内生成n molO2的同时生成2n molNO2
②2v(NO2、正)=v(O2、逆)
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )| A. | 若戊为一种强碱且焰色反应为黄色,则上述反应可能都属于氧化还原反应 | |
| B. | 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙一定是铜和稀硝酸 | |
| C. | 若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲 | |
| D. | 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色 |
 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式K=$\frac{[CH{\;}_{3}OCH{\;}_{3}]•[H{\;}_{2}O]{\;}^{3}}{[CO{\;}_{2}]{\;}^{2}•[H{\;}_{2}]{\;}^{6}}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是BD.
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3
D.容器内压强保持不变
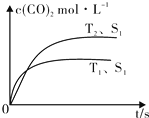
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) $\stackrel{催化剂}{?}$2CO2 (g)+N2 (g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
 麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).
麻黄素中含氧官能团的名称是羟基,属于醇类(填“醇”或“酚”).
 化工工业中常用乙苯脱氢的方法制备苯乙烯.
化工工业中常用乙苯脱氢的方法制备苯乙烯. (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol