题目内容
7.锌和浓度不同的硝酸会发生不同的反应,其中被氧化的锌和被还原的硝酸的微粒个数之比为3:2的是( )| A. | Zn+HNO3(浓)--Zn(NO3)2+NO2↑+H2O | B. | Zn+HNO3(浓)--Zn(NO3)2+NO↑+H2O | ||
| C. | Zn+HNO3(很稀)--Zn(NO3)2+NO2↑+H2O | D. | Zn+HNO3(很稀)--Zn(NO3)2+NH4NO3+H2O |
分析 锌和浓度不同的硝酸发生氧化还原反应,如果被氧化的锌和被还原的硝酸的微粒个数之比为3:2,假设锌为3mol,则被还原的硝酸为2mol,结合电子的转移数目相等计算
解答 解:锌和浓度不同的硝酸发生氧化还原反应,如果被氧化的锌和被还原的硝酸的微粒个数之比为3:2,假设锌为3mol,则被还原的硝酸为2mol,反应后Zn被氧化为+2价,设硝酸还原产物为x价,
则3mol×(2-0)=2mol×(5-x),
x=2,则产物为NO,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒和原子守恒的应用为解答的关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
相关题目
5.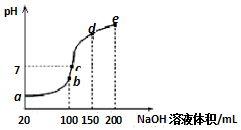 常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
 常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )| A. | b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 图中b、c、d、三点溶液中水的电离程度最大的是c点 | |
| C. | b点后滴加NaOH溶液过程中,NH3•H2O的电离程度逐渐减小 | |
| D. | pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42-)+c(OH-) |
15.关于Cl-和Cl2的说法正确的是( )
| A. | 都能与Fe反应生成FeCl3 | B. | 与AgNO3溶液反应都生成白色沉淀 | ||
| C. | 均有毒 | D. | 都具有氧化性 |
12.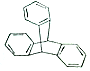 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )| A. | 分子式为C20H14 | B. | 属于苯的同系物 | ||
| C. | 能与溴水发生加成反应 | D. | 分子中所有原子可能在同一平面上 |
16.在生产过程中,除去铁制品上的铁锈,可先用下列溶液洗涤的是( )
| A. | NaOH | B. | CuSO4 | C. | HCl | D. | NaCl |
17.下列离子方程式中,正确的是( )
| A. | 氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO${\;}_{3}^{2-}$+H2O | |
| B. | 向澄清石灰水中通入过量CO2;Ca2++2OH-+CO2=CaCO3↓++H2O | |
| C. | 硫酸氢钠溶液中加入过量氢氧化钡溶液:2HSO${\;}_{4}^{-}$+2Ba2++2OH-=2BaSO4↓+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量石灰水:Ca2++OH-+HCO${\;}_{3}^{-}$=CaCO3↓+H2O |
 某水溶液X中只可能含有Al3+、CO32-、Cl-、SiO32-、SO42-、Fe2+中的若干种离子.某同学对该溶液进行了如下实验:
某水溶液X中只可能含有Al3+、CO32-、Cl-、SiO32-、SO42-、Fe2+中的若干种离子.某同学对该溶液进行了如下实验: