题目内容
在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3.铜粉可溶解的是( )
| A、①② | B、①④ | C、②③ | D、②④ |
考点:铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:根据铜的化学性质,如:铜不能与非氧化性酸反应,但可以和氧化性酸反应,能与具有氧化性的FeCl3溶液、酸性条件下硝酸盐等反应.
解答:
解:①因铜不如铁活泼,则铜不能与FeCl2反应,故①错误;
②因Fe2O3能与稀硫酸反应:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,Fe2(SO4)3能与铜粉反应:Fe2(SO4)3+Cu═2FeSO4+CuSO4,铜粉溶解,故②正确;
③Zn、Cu、H2SO4形成原电池,加快了反应,但发生的化学反应为Zn+H2SO4═ZnSO4+H2↑,Zn溶解,故③错误;
④根据铜与稀HNO3反应,由该反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,故④正确.
故选D.
②因Fe2O3能与稀硫酸反应:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,Fe2(SO4)3能与铜粉反应:Fe2(SO4)3+Cu═2FeSO4+CuSO4,铜粉溶解,故②正确;
③Zn、Cu、H2SO4形成原电池,加快了反应,但发生的化学反应为Zn+H2SO4═ZnSO4+H2↑,Zn溶解,故③错误;
④根据铜与稀HNO3反应,由该反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,故④正确.
故选D.
点评:本题主要考查了金属铜的化学性质,对于铜和硝酸的反应要特别注意,可以直接加硝酸也可以分步产生:先加非氧化性酸(如盐酸、稀硫酸)后加硝酸盐.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA为阿伏加德罗常数的值.下列关于0.2mol/L 硝酸钡溶液的不正确说法是( )
| A、1升溶液中所含阴、阳离子总数是0.6NA |
| B、1升溶液中含有0.2NA个NO3-离子 |
| C、500毫升溶液中的Ba2+离子浓度是0.2mol/L |
| D、500毫升溶液中的NO3-离子浓度是0.2mol/L |
下列说法中正确的是( )
| A、饮用水可以用明矾、漂白粉来净化,两者的作用原理相同 |
| B、常温常压下,78gNa2O2固体中所含阴离子数一定为NA |
| C、NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键 |
| D、实验室中浓硝酸保存在带橡胶塞的棕色细口试剂瓶中 |
在稀硫酸中加入铜粉,铜粉不溶解,再加入某X物质,发现铜粉逐渐溶解,问神秘的X不可能是( )
| A、FeCl3 |
| B、HNO3 |
| C、HCl |
| D、KNO3 |
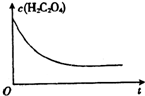 某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.
某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.