题目内容
20.下列反应能够发生:H2SO3+I2+H2O=H2SO4+2HI,2FeCl3+2HI=2FeCl2=2HCl+I2
3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+2H2O+NO↑
由此判断下列有关物质还原性由强到弱的顺序正确的是( )
| A. | I->Fe2+>H2SO3>NO | B. | NO>Fe2+>H2SO3>I- | ||
| C. | Fe2+>I->H2SO3>NO | D. | H2SO3>I->Fe2+>NO |
分析 氧化还原反应中氧化剂的氧化性大于氧化产物;还原剂的还原性大于还原产物;反应中元素化合价升高的做还原剂,得到氧化产物,元素化合价降低的做氧化剂被还原得到还原产物.
解答 解:根据下列反应:
H2SO3+I2+H2O=2HI+H2SO4反应中还原剂H2SO3的还原性大于还原产物HI;
FeCl3+2HI=2FeCl2+2HCl+I2反应中还原剂HI的还原性大于还原产物FeCl2;
3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+2H2O+NO↑反应中还原剂FeCl2的还原性大于还原产物NO;
综上所述:物质还原性由强到弱的顺序是:H2SO3>I->Fe2+>NO;
故选D.
点评 本题考查了氧化还原反应的强弱比较,主要是还原剂的还原性大于还原产物;的规律的应用,标注化合价,判断氧化剂还原剂,氧化产物,还原产物是解题关键.

练习册系列答案
相关题目
10.下列有关物质用途的说法错误的是( )
| A. | 硅可用作半导体材料 | |
| B. | 甲醛可用作食品防腐剂 | |
| C. | 氧化铝熔点高,常用于制造耐火材料 | |
| D. | 高压钠灯发出黄光,透雾能力强,常用于道路和广场照明 |
11.化学与生活、社会发展息息相关,下列说法正确的是( )
| A. | 华为自主研发的“麒麟”芯片与光导纤维是同种材料 | |
| B. | 研发煤炭的洁净、高效利用技术,保护生态环境 | |
| C. | 聚氯乙烯可作为包装材料,不会造成环境污染 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
8.下列物质属于共价化合物的是( )
| A. | NH4Cl | B. | MgO | C. | H2O | D. | CaCl2 |
15.下列离子方程式中,正确的是( )
| A. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 过氧化钠与反应:2O22-+2H2O=4OH-+O2↑ | |
| C. | 碳酸氢钠与稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓ |
4.下列有关晶体的叙述中,不正确的是( )
| A. | 氯化钠和氯化铯晶体中,阳离子的配位数均为6 | |
| B. | 金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键 | |
| C. | 金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8 | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
5.观察下列有关实验装置,相关评价错误的是( )
| A. | 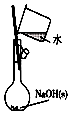 用于配制0.10 mol•L-1 NaOH溶液;评价:正确 | |
| B. |  用于测定中和热;评价:错误,装置中缺少了环形玻璃搅拌棒 | |
| C. | 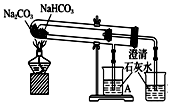 用于比较Na2CO3、NaHCO3的热稳定性;评价:正确 | |
| D. | 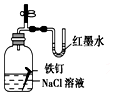 证明铁发生吸氧腐蚀时空气参加反应;评价:正确 |