题目内容
4.下列有关晶体的叙述中,不正确的是( )| A. | 氯化钠和氯化铯晶体中,阳离子的配位数均为6 | |
| B. | 金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键 | |
| C. | 金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8 | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
分析 A、氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8;
B、金刚石为三维网状结构,一个碳与四个碳原子形成共价键;
C、观察钠晶胞结构即体心结构可知,每个钠原子周围距离最近的钠原子有8个;
D、采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数.
解答 解:A、氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,则氯化钠和氯化铯晶体中氯离子的配位数不相同,故A错误;
B、金刚石为三维网状结构,一个碳与四个碳原子形成共价键,所以碳原子以sp3杂化,故B正确;
C、金属钠的晶体采用体心立方堆积,所以每个晶胞含1+8×$\frac{1}{8}$个原子,每个钠原子周围距离最近的钠原子有8个,所以配位数为8,故C正确;
D.采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数为12,所以在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子,故D正确;
故选A.
点评 本题考查晶体结构,了解典型晶体的构型是解本题关键,离子晶体中离子配位数的判断是常考查点,也是学习难点.

练习册系列答案
相关题目
19.下列物质的电离方程式书写正确的是( )
| A. | Na2SO4═Na++SO42- | B. | Ba(OH)2═Ba2++(OH)22- | ||
| C. | CH3COOH═CH3COO-+H+ | D. | NH4Cl═NH4++Cl- |
20.下列反应能够发生:
H2SO3+I2+H2O=H2SO4+2HI,2FeCl3+2HI=2FeCl2=2HCl+I2
3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+2H2O+NO↑
由此判断下列有关物质还原性由强到弱的顺序正确的是( )
H2SO3+I2+H2O=H2SO4+2HI,2FeCl3+2HI=2FeCl2=2HCl+I2
3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+2H2O+NO↑
由此判断下列有关物质还原性由强到弱的顺序正确的是( )
| A. | I->Fe2+>H2SO3>NO | B. | NO>Fe2+>H2SO3>I- | ||
| C. | Fe2+>I->H2SO3>NO | D. | H2SO3>I->Fe2+>NO |
9.纯锌和稀硫酸反应速率很小,为了加快锌的溶解和放出H2的速率,可以加入少量( )
| A. | 硫酸铜晶体 | B. | 稀盐酸 | C. | 镁带 | D. | 碘化钾溶液 |
16.下列说法中正确的是( )
| A. | 离子键是阴阳离子间存在的静电引力 | |
| B. | 失电子难的原子获得电子的能力一定强 | |
| C. | 在化学反应中,某元素由化合态变为游离态,该元素被还原 | |
| D. | 电子层结构相同的不同离子,其半径随核电荷数增多而减小 |
13.下列有关化学用语表示正确的是( )
| A. | K+的结构示意图: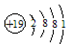 | |
| B. | B、基态氮原子的电子排布图 | |
| C. | 水的电子式: | |
| D. | D、基态铬原子(24Cr)的价电子排布式:3d44s2 |
14.已知反应
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
由此可以推断下列结论正确的是( )
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
由此可以推断下列结论正确的是( )
| A. | 1 mol碳完全燃烧放出的热大于110.5 kJ | |
| B. | ①的焓变为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液完全反应生成1 mol水时放热为57.3 kJ | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.