题目内容
11.化学与生活、社会发展息息相关,下列说法正确的是( )| A. | 华为自主研发的“麒麟”芯片与光导纤维是同种材料 | |
| B. | 研发煤炭的洁净、高效利用技术,保护生态环境 | |
| C. | 聚氯乙烯可作为包装材料,不会造成环境污染 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
分析 A.光导纤维主要成分为二氧化硅,为绝缘体;
B.煤炭汽化、液化可以提高煤炭的利用率,减少有毒气体的排放;
C.聚氯乙烯难降解;
D.特种钢缆为金属材料.
解答 解:A.硅为良好的半导体,用作芯片,光导纤维主要成分为二氧化硅,为绝缘体,故A错误;
B.煤炭汽化、液化可以提高煤炭的利用率,减少有毒气体的排放,所以有利于保护生态环境,故B正确;
C.聚氯乙烯难降解,大量使用能够引起白色污染,故C错误;
D.特种钢缆为金属材料,不是非金属材料,故D错误;
故选:B.
点评 本题考查物质的组成、结构与性质,为高频考点,把握物质的性质、应用及化学与生活的关系为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
1.甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H
?下表所列数据是该反应在不同温度下的化学平衡常数(K).
由表中数据判断反应I为放热反应(填“吸”或“放”).
?某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=(△H1-△H2+4△H3)/2kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72?)时,实验室利用如图装置模拟该法:
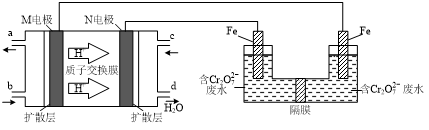
①N电极的电极反应式为O2+4e?+4H+=2H2O.
②请完成电解池中Cr2O72?转化为Cr3+的离子反应方程式:
Cr2O72?+6Fe2++14H+═2Cr3++6Fe3++7H2O
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10?5mol•L-1 时,Cr3+沉淀完全,此时溶液的pH=5.6. (已知,Ksp=6.4×10?31,lg2=0.3)
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H
?下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
?某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=(△H1-△H2+4△H3)/2kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72?)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为O2+4e?+4H+=2H2O.
②请完成电解池中Cr2O72?转化为Cr3+的离子反应方程式:
Cr2O72?+6Fe2++14H+═2Cr3++6Fe3++7H2O
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10?5mol•L-1 时,Cr3+沉淀完全,此时溶液的pH=5.6. (已知,Ksp=6.4×10?31,lg2=0.3)
2.化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| B. | 大力推广燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| C. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 | |
| D. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
19.下列物质的电离方程式书写正确的是( )
| A. | Na2SO4═Na++SO42- | B. | Ba(OH)2═Ba2++(OH)22- | ||
| C. | CH3COOH═CH3COO-+H+ | D. | NH4Cl═NH4++Cl- |
6.下列与实验相关的说法正确的是( )
| A. | 向碘水中加入有机溶剂提取碘,只能从分液漏斗下口分离出含碘的有机层 | |
| B. | 加入稀盐酸产生无色气体,通入品红溶液不褪色,原溶液中一定含CO32-或HCO3- | |
| C. | 在容量瓶定容时,仰视刻度线滴加蒸馏水,则配制溶液的物质的量浓度偏小 | |
| D. | 进行酸碱中和滴定时,眼睛要始终注视滴定管液面高度的变化 |
16.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 组别 物质 | 甲 | 乙 | 丙 |
| A | Al2O3 | H2SO4 | NaOH |
| B | NO2 | HNO3 | NH3 |
| C | SiO2 | HF | NaOH |
| D | SO2 | Ca(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
3.下列图示实验能达到实验目的是( )


| A. | 制备少量O2 | B. | 制备无水氯化铁 | ||
| C. | 比较元素非金属性强弱 | D. | 收集氨气 |
20.下列反应能够发生:
H2SO3+I2+H2O=H2SO4+2HI,2FeCl3+2HI=2FeCl2=2HCl+I2
3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+2H2O+NO↑
由此判断下列有关物质还原性由强到弱的顺序正确的是( )
H2SO3+I2+H2O=H2SO4+2HI,2FeCl3+2HI=2FeCl2=2HCl+I2
3FeCl2+4HNO3=2FeCl3+Fe(NO3)3+2H2O+NO↑
由此判断下列有关物质还原性由强到弱的顺序正确的是( )
| A. | I->Fe2+>H2SO3>NO | B. | NO>Fe2+>H2SO3>I- | ||
| C. | Fe2+>I->H2SO3>NO | D. | H2SO3>I->Fe2+>NO |
16.下列说法中正确的是( )
| A. | 离子键是阴阳离子间存在的静电引力 | |
| B. | 失电子难的原子获得电子的能力一定强 | |
| C. | 在化学反应中,某元素由化合态变为游离态,该元素被还原 | |
| D. | 电子层结构相同的不同离子,其半径随核电荷数增多而减小 |