题目内容
根据如图1化学电池装置,回答下列问题:
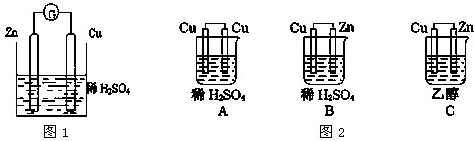
(1)负极发生的反应式为 ,观察到得现象是 .
(2)正极材料是 ,电极反应为 ,观察到得现象是 .
(3)该装置的能量转化: .
(4)该装置中电子流向: →电流表→ .
(5)在如图2所示的装置中,能够发生原电池反应的是 .

(1)负极发生的反应式为
(2)正极材料是
(3)该装置的能量转化:
(4)该装置中电子流向:
(5)在如图2所示的装置中,能够发生原电池反应的是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)该装置中,锌易失电子作负极、铁作正极,负极上锌生成锌离子进入溶液,导致其质量逐渐减小;
(2)正极上氢离子得电子生成氢气;
(3)该装置是将化学能转化为电能的装置;
(4)该装置中电子从负极沿导线流向正极;
(5)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
(2)正极上氢离子得电子生成氢气;
(3)该装置是将化学能转化为电能的装置;
(4)该装置中电子从负极沿导线流向正极;
(5)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答:
解:(1)该装置中,锌易失电子作负极、铁作正极,负极上锌生成锌离子进入溶液,导致其质量逐渐减小,所以看到的现象是金属锌逐渐溶解,负极电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;锌逐渐溶解;
(2)正极是Cu,正极上电极反应式为2H++2e-=H2↑,观察到的现象是:铜片上有气泡生成,故答案为:铜;2H++2e-=H2↑;铜片上有气泡生成;
(3)该装置是将化学能转化为电能的装置,故答案为:化学能转化为电能;
(4)该装置中电子从负极沿导线流向正极,即从锌流向铜,故答案为:锌;铜;
(5)A.该装置不能自发的进行氧化还原反应,不能构成原电池,故错误;
B.该装置符合原电池构成条件,能构成原电池,故正确;
C.该装置不能自发的进行氧化还原反应,不能构成原电池,故错误;
故选B.
(2)正极是Cu,正极上电极反应式为2H++2e-=H2↑,观察到的现象是:铜片上有气泡生成,故答案为:铜;2H++2e-=H2↑;铜片上有气泡生成;
(3)该装置是将化学能转化为电能的装置,故答案为:化学能转化为电能;
(4)该装置中电子从负极沿导线流向正极,即从锌流向铜,故答案为:锌;铜;
(5)A.该装置不能自发的进行氧化还原反应,不能构成原电池,故错误;
B.该装置符合原电池构成条件,能构成原电池,故正确;
C.该装置不能自发的进行氧化还原反应,不能构成原电池,故错误;
故选B.
点评:本题考查了原电池原理,明确正负极的判断方法及原电池构成原理即可解答,会根据实验现象书写相应电极反应式,题目难度不大.

练习册系列答案
相关题目
一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成H2的总量,可向反应容器中加入适量的( )
| A、氢氧化钠固体 |
| B、硝酸钠溶液 |
| C、硫酸钾溶液 |
| D、碳酸钠固体 |
A元素的阳离子、B元素的阳离子和C元素的阴离子都具有相同的电子层结构,A的阳离子半径大于B的阳离子半径,则A、B、C三种元素的原子序数由小到大的顺序是( )
| A、A<B<C |
| B、B<C<A |
| C、B<A<C |
| D、C<A<B |
下列离子方程式书写正确的是( )
| A、把过量碳酸氢钠溶液加入到氢氧化钡溶液中:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
| B、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7(常温时):Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、标况下112mL Cl2通入10mL 1mol/L的FeBr2溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
 实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液
实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液
 碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题:
碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题: