题目内容
反应:2Cl2(g)+2H2O(g)?4HCl(g)+O2(g)(吸热反应)建立平衡后,在其它条件不变时(填“变大”、“变小”或“不变”):
(1)体积恒定情况下,通入O2后H2O的物质的量 ;O2的物质的量 (与未通入O2之前比较);HCl的物质的量 .
(2)体积恒定情况下,通入Ne后HCl的物质的量 .
(3)加入催化剂,HCl的物质的量 .
(1)体积恒定情况下,通入O2后H2O的物质的量
(2)体积恒定情况下,通入Ne后HCl的物质的量
(3)加入催化剂,HCl的物质的量
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)体积恒定情况下,通入O2后,平衡逆向移动;
(2)保持容器体积不变,加入He,对反应无影响,所以HCl的物质的量不变.
(3)催化剂改变反应速率不改变化学平衡;
(2)保持容器体积不变,加入He,对反应无影响,所以HCl的物质的量不变.
(3)催化剂改变反应速率不改变化学平衡;
解答:
解:(1)体积恒定情况下,通入O2后,平衡逆移,水的物质的量增大,达到锌平衡O2的物质的量增大,氯化氢物质的量减小;
故答案为:变大,变大,变小;
(2)保持容器体积不变,加入He,容器体积不变,各物质的浓度不变,所以对反应无影响,所以HCl的物质的量不变,故答案为:不变;
(3)加入催化剂,降低反应的活化能,改变反应速率不改变化学平衡,HCl的物质的量不变;
故答案为:不变.
故答案为:变大,变大,变小;
(2)保持容器体积不变,加入He,容器体积不变,各物质的浓度不变,所以对反应无影响,所以HCl的物质的量不变,故答案为:不变;
(3)加入催化剂,降低反应的活化能,改变反应速率不改变化学平衡,HCl的物质的量不变;
故答案为:不变.
点评:本题考查了化学平衡的影响因素分析,注意平衡移动原理的应用,题目较简单.

练习册系列答案
相关题目
区分强电解质和弱电解质的依据是( )
| A、溶解度的大小 |
| B、是否存在电离平衡 |
| C、属于离子化合物还是共价化合物 |
| D、导电性的强弱 |
研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化.据此判断以下叙述中错误的是( )
| A、金属钠与氯气反应生成氯化钠后,稳定性增强,体系的能量降低 |
| B、物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来 |
| C、氮分子内部存在着很强的共价键,故通常状况下氮气的化学性质很不活泼 |
| D、需加热才能发生的反应一定是吸收能量的反应 |
有甲、乙、丙三种溶液,进行如图操作,则甲、乙、丙三种溶液可能是( )
Na2CO3溶液
白色沉淀
沉淀溶解并产生气体
产生白色沉淀.
Na2CO3溶液
| 甲 |
| 过量乙 |
| 丙 |
| A、BaCl2、H2SO4、MgCl2 |
| B、CaCl2、HNO3、BaCl2 |
| C、CaCl2、HNO3、NaCl |
| D、BaCl2、HCl、Na2SO4 |
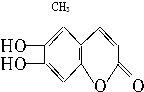 中草药素皮中含有的七叶树内酯 (碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别是( )
中草药素皮中含有的七叶树内酯 (碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别是( )| A、3 mol,2 mol |
| B、3 mol,4 mol |
| C、2 mol,3 mol |
| D、4 mol,4 mol |