题目内容
 实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液
实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液(1)无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,至少还需要的一种仪器是
(2)若用胆矾晶体进行配制,需用托盘天平称取CuSO4?5H2O的质量为
(3)实验室用4mol/L的硫酸铜溶液稀释配制溶液所需的实验步骤有:
其中正确的操作顺序为
①往烧杯中加入约100ml水进行初步稀释,冷却至室温
②用量筒量取一定体积4mol/L 的硫酸铜溶液于一烧杯中
③计算所需4mol/L 硫酸铜溶液的体积
④将溶液颠倒摇匀后转存于试剂瓶
⑤加水至液面离容量瓶1-2cm处改用胶头滴管进行定容
⑥洗涤烧杯和玻璃棒2-3次并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
⑦将溶液转移入容量瓶
(4)配制溶液过程中,如果出现以下情况,对结果有何影响(填“偏高”、“偏低”或“无影响”)
A.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
B.定容时俯视刻度线
C.容量瓶未干燥即用来配制溶液
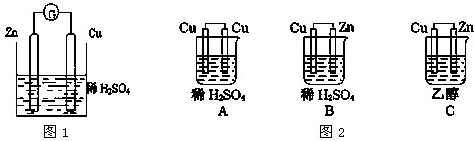
(5)实验过程中用到蒸馏水.如图为实验室制取蒸馏水的装置示意图.图中的两处明显的错误是
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)配制250mL溶液一定需要250mL的容量瓶;使用容量瓶前必须检查容量瓶是否漏液;
(2)根据250mL 0.2mol/L CuSO4溶液中溶质硫酸铜的物质的量分别计算出需要胆矾的质量、4mol/L的CuSO4溶液的体积;
(3)根据配制一定物质的量浓度的溶液步骤对各操作进行排序;
(4)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(5)根据蒸馏操作方法及图示装置找出图中的两处明显的错误;蒸馏操作中需要加入碎瓷片防止暴沸.
(2)根据250mL 0.2mol/L CuSO4溶液中溶质硫酸铜的物质的量分别计算出需要胆矾的质量、4mol/L的CuSO4溶液的体积;
(3)根据配制一定物质的量浓度的溶液步骤对各操作进行排序;
(4)根据c=
| n |
| V |
(5)根据蒸馏操作方法及图示装置找出图中的两处明显的错误;蒸馏操作中需要加入碎瓷片防止暴沸.
解答:
解:(1)配制0.2mol/L CuSO4溶液250mL,一定需要250mL的容量瓶;容量瓶有瓶塞,在配制过程中需要摇匀,无法避免漏液,需要据此容量瓶是否漏水,
故答案为:250mL容量瓶;检查是否漏液;
(2)250mL 0.2mol/L的硫酸铜溶液中含有溶质硫酸铜的物质的量为:0.2mol/L×0.25L=0.05mol,需要胆矾的质量为:250g/mol×0.05mol=12.5g;需要4mol/L的CuSO4溶液的体积为:
=0.0125L=12.5mL,
故答案为:12.5;12.5;
(3)用4mol/L的硫酸铜溶液配制250mL 0.2mol/L的硫酸铜溶液的步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,所以正确的操作顺序为:③②①⑦⑥⑤④,
故答案为:③②①⑦⑥⑤④;
(4)A.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致配制的溶液体积偏大,配制的溶液浓度偏低,
故答案为:偏低;
B.定容时俯视刻度线,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液的浓度偏高,
故答案为:偏高;
C.容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的最终体积都没有影响,不会影响配制结果,
故答案为:无影响;
(5)蒸馏操作中,温度计用于测量馏出物温度,所以温度计应该放在蒸馏烧瓶的支管口处;为了提高冷凝效果,冷凝管的通水方向应该为逆向通水法,即从冷凝管的下口进水,上口出水;为了避免混合液暴沸,应该在蒸馏烧瓶中加热碎瓷片防止暴沸,
故答案为:温度计的水银球应在蒸馏烧瓶支管口处;冷凝器应为下口进水,上口出水;碎瓷片(沸石).
故答案为:250mL容量瓶;检查是否漏液;
(2)250mL 0.2mol/L的硫酸铜溶液中含有溶质硫酸铜的物质的量为:0.2mol/L×0.25L=0.05mol,需要胆矾的质量为:250g/mol×0.05mol=12.5g;需要4mol/L的CuSO4溶液的体积为:
| 0.05mol |
| 4mol/L |
故答案为:12.5;12.5;
(3)用4mol/L的硫酸铜溶液配制250mL 0.2mol/L的硫酸铜溶液的步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,所以正确的操作顺序为:③②①⑦⑥⑤④,
故答案为:③②①⑦⑥⑤④;
(4)A.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致配制的溶液体积偏大,配制的溶液浓度偏低,
故答案为:偏低;
B.定容时俯视刻度线,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液的浓度偏高,
故答案为:偏高;
C.容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液的最终体积都没有影响,不会影响配制结果,
故答案为:无影响;
(5)蒸馏操作中,温度计用于测量馏出物温度,所以温度计应该放在蒸馏烧瓶的支管口处;为了提高冷凝效果,冷凝管的通水方向应该为逆向通水法,即从冷凝管的下口进水,上口出水;为了避免混合液暴沸,应该在蒸馏烧瓶中加热碎瓷片防止暴沸,
故答案为:温度计的水银球应在蒸馏烧瓶支管口处;冷凝器应为下口进水,上口出水;碎瓷片(沸石).
点评:本题考查了配制一定物质的量浓度的溶液的方法、蒸馏操作装置判断,该题是中等难度的试题,试题基础性强,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,该题的难点在于误差分析,注意明确误差分析的方法.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
分子式为C3H7Cl的同分异构体有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.