题目内容
下列元素的最外层电子数为5的是( )
| A、H | B、Li | C、Na | D、P |
考点:原子核外电子排布,元素周期表的结构及其应用
专题:原子组成与结构专题,元素周期律与元素周期表专题
分析:选项中四种元素均为主族元素,主族序数=最外层电子数,最外层电子数为5,说明该元素位于第ⅤA族,以此分析.
解答:
解:A、H位于第ⅠA族,最外层电子数为1,故A错误;
B、Li位于第ⅠA族,最外层电子数为1,故B错误;
C、Na位于第ⅠA族,最外层电子数为1,故C错误;
D、P位于第ⅤA族,最外层电子数为5,故D正确;
故选D.
B、Li位于第ⅠA族,最外层电子数为1,故B错误;
C、Na位于第ⅠA族,最外层电子数为1,故C错误;
D、P位于第ⅤA族,最外层电子数为5,故D正确;
故选D.
点评:本题考查了主族元素的原子核外电子结构,可根据其在周期表中的位置推断其结构,难度不大.

练习册系列答案
相关题目
下列说法或有关化学用语的表达正确的是( )
| A、在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B、基态Fe原子的外围电子排布图为: |
| C、因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D、根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
用石墨做电极电解500mLCuSO4溶液.通电一段时间后,测定两极均产生2.24L气体(标准状况下,忽略气体溶解),则CuSO4溶液的物质的量浓度为( )
| A、0.4 mol.L-1 |
| B、0.2 mol.L-1 |
| C、0.3 mol.L-1 |
| D、0.05mol.L-1 |
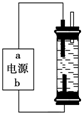 使用氯化钠作原料可以得到多种产品.
使用氯化钠作原料可以得到多种产品. 酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.