题目内容
 酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.(1)利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
3CH3CH2OH+2KMnO4=3CH3CHO+2MnO2+2KOH+2H2O 上述反应中发生还原反应的过程是
(2)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,溶液变蓝,乙醇被氧化为乙醛,该反应的化学方程式为:
(3)已知乙醇与CO的燃烧热分别为1366.8KJ/mol、283.0KJ/mol,写出乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
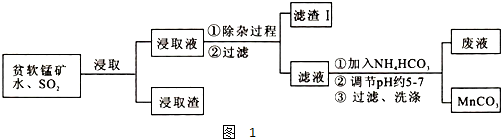
(4)如图是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为:
(5)①常温下,将40mL0.10mol?L-1氢氧化钠溶液逐滴加入到20mL0.10mol?L-1醋酸溶液中,充分反应(体积变化忽略不计).则溶液中离子浓度由大到小的顺序为
②常温下,将cmol/L的醋酸溶液与0.02mol/LNaOH溶液等体积混合后溶液 刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=
考点:酸碱混合时的定性判断及有关ph的计算,氧化还原反应,热化学方程式
专题:基本概念与基本理论
分析:(1)氧化剂发生还原反应,氧化剂中某元素的化合价降低;
(2)五氧化二碘与乙醇反应发生氧化还原反应生成乙醛和水;
(3)根据CO和乙醇的热方程式,结合盖斯定律来分析乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(4)根据图示得出酸性燃料电池的反应物和生成物,再根据原电池原理写出该电池的反应式;
(5)①n(NaOH)=0.004mol,n(HAc)=0.002mol,反应后NaOH剩余;
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,以此计算.
(2)五氧化二碘与乙醇反应发生氧化还原反应生成乙醛和水;
(3)根据CO和乙醇的热方程式,结合盖斯定律来分析乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(4)根据图示得出酸性燃料电池的反应物和生成物,再根据原电池原理写出该电池的反应式;
(5)①n(NaOH)=0.004mol,n(HAc)=0.002mol,反应后NaOH剩余;
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,以此计算.
解答:
解:(1)Mn元素的化合价由+7价降低为+4,则Mn元素得到电子发生还原反应,还原过程为KMnO4→MnO2,故答案为:KMnO4→MnO2;
(2)五氧化二碘与乙醇反应生成乙醛和水,该反应为I2O5+5CH3CH2OH=I2+5CH3CHO+5H2O,故答案为:I2O5+5CH3CH2OH=I2+5CH3CHO+5H2O;
(3)①CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1366.8kJ?mol-1,
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1,
由盖斯定律可知用①-②得反应CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l),该反应的反应热△H=-1366.8kJ?mol-1-(-556.0kJ?mol-1)=-800.8kJ?mol-1,
故答案为:CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l)△H=-800.8kJ?mol-1;
(4)根据图可知,该原电池的燃料为乙醇和氧气,生成物乙酸和水,电解质为酸性溶液,原电池负极失去电子发生了氧化反应,所以负极反应为乙醇失去电子生成乙酸,电极反应为:CH3CH2OH+H2O-4e-=CH3COOH+4H+,正极在酸性条件下氧气得到电子发生了还原反应:O2+4H++4e-=2H2O,
故答案为:CH3CH2OH+H2O-4e-=CH3COOH+4H+;O2+4H++4e-=2H2O;
(5)①40mL0.10mol?L-1氢氧化钠溶液中n(NaOH)=0.04L×0.1mol/L=0.004mol/L,20mL0.10mol?L-1醋酸溶液中n(CH3COOH)=0.02L×0.1mol/L=0.002mol/L,由于发生反应:CH3COOH+NaOH=CH3COONa+H2O,可知醋酸完全反应,反应后溶液为0.002molNaOH、0.002molCH3COONa混合溶液,溶液中呈碱性,溶液中醋酸根水解,故c(OH -)>c(CH3COO -),水解程度微弱,故c(CH3COO -)>c(H+),故溶液中离子浓度c(Na+)>c(OH -)>c(CH3COO -)>c(H+),
故答案为:c(Na+)>c(OH -)>c(CH3COO -)>c(H+);
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,所以用含c的代数式表示CH3COOH的电离常数Ka=
=
mol?L-1,故答案为:
mol?L-1.
(2)五氧化二碘与乙醇反应生成乙醛和水,该反应为I2O5+5CH3CH2OH=I2+5CH3CHO+5H2O,故答案为:I2O5+5CH3CH2OH=I2+5CH3CHO+5H2O;
(3)①CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1366.8kJ?mol-1,
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1,
由盖斯定律可知用①-②得反应CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l),该反应的反应热△H=-1366.8kJ?mol-1-(-556.0kJ?mol-1)=-800.8kJ?mol-1,
故答案为:CH3CH2OH(l)+2O2(g)=2CO(g)+3H2O(l)△H=-800.8kJ?mol-1;
(4)根据图可知,该原电池的燃料为乙醇和氧气,生成物乙酸和水,电解质为酸性溶液,原电池负极失去电子发生了氧化反应,所以负极反应为乙醇失去电子生成乙酸,电极反应为:CH3CH2OH+H2O-4e-=CH3COOH+4H+,正极在酸性条件下氧气得到电子发生了还原反应:O2+4H++4e-=2H2O,
故答案为:CH3CH2OH+H2O-4e-=CH3COOH+4H+;O2+4H++4e-=2H2O;
(5)①40mL0.10mol?L-1氢氧化钠溶液中n(NaOH)=0.04L×0.1mol/L=0.004mol/L,20mL0.10mol?L-1醋酸溶液中n(CH3COOH)=0.02L×0.1mol/L=0.002mol/L,由于发生反应:CH3COOH+NaOH=CH3COONa+H2O,可知醋酸完全反应,反应后溶液为0.002molNaOH、0.002molCH3COONa混合溶液,溶液中呈碱性,溶液中醋酸根水解,故c(OH -)>c(CH3COO -),水解程度微弱,故c(CH3COO -)>c(H+),故溶液中离子浓度c(Na+)>c(OH -)>c(CH3COO -)>c(H+),
故答案为:c(Na+)>c(OH -)>c(CH3COO -)>c(H+);
②呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,所以用含c的代数式表示CH3COOH的电离常数Ka=
| 10-7×0.01 | ||
|
| 2×10-9 |
| (c-0.02) |
| 2×10-9 |
| (c-0.02) |
点评:本题综合性较强,涉及平衡常数、反应热计算、离子浓度比较、电离平衡、溶度积的应用等,属于拼合型题目,对学生的心理有较高的要求,(5)中计算为易错点,注意忽略计算,题目难度中等.

练习册系列答案
相关题目
下列元素的最外层电子数为5的是( )
| A、H | B、Li | C、Na | D、P |
从海水中提取溴常用的一种工艺涉及以下过程:则正确的步骤为( )
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr.
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr.
| A、②①③④ | B、①②③④ |
| C、③②①④ | D、②①④③ |
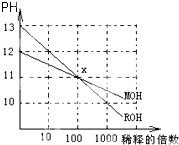 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )| A、等PH的MOH和ROH溶液,稀释相同倍数,ROH 溶液的PH略大 |
| B、稀释前,c(ROH)=10c(MOH) |
| C、常温下pH之和为14的醋酸和ROH溶液等体积混合,溶液呈碱性 |
| D、在x点,c(M+)=c(R+) |
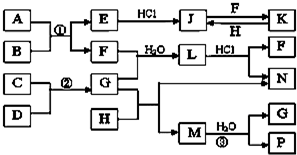 如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).