题目内容
2.已知25℃时几种弱酸的电离常数如表,下列说法正确的是( )| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液,pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol/L HCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c( Na+)>c(CN-),则a 一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 将少量的H2S通入NaCN溶液中,反应为:H2S+2CN-=2HCN+S2- |
分析 A.电离平衡常数越大,酸性越强,电离程度越大,溶液的pH越高;
B.等浓度时生成NaCN,CN-离子水解,则c(Na+)>c(CN-)时a可稍大于b;
C.根据混合液中的电荷守恒判断;
D.HCN的酸性大于HS-,硫化氢少量时生成HS-.
解答 解:A.由表格中的数据可知,醋酸电离平衡常数最大,酸性最强,则酸性越强,盐的水解越弱,所以等物质的量浓度溶液的pH关系为pH(Na2S)>pH(NaCN)>pH(CH3COONa),故A错误;
B.等物质的量时生成NaCN,CN-离子水解,则c(Na+)>c(CN-),所以a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),a有可能略大于b,故B错误;
C.根据NaHS和Na2S的混合溶液中的电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故C正确;
D.将少量的H2S通入NaCN溶液中,由于酸性:HCN>HS-,则H2S少量时生成的是HS-,正确的离子方程式为:H2S+CN-=HCN+HS-,故D错误;
故选C.
点评 本题离子浓度大小比较、弱电解质的电离平衡的应用,题目难度中等,试题综合性较强,根据表格中数据正确判断各酸的酸性强弱为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理原理的含义及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.W、X、Y、Z、Q是五种常见的短周期主族元素,原子序数依次增大,在周期表中W原子半径最小;X元素原子核外电子总数是其次外层电子数的3倍;W和Y、X和Z均位于同一主族;Q的非金属性在同周期元素中最强.下列说法正确的是( )
| A. | 简单离子半径:Y>Q | |
| B. | Q分别与X、Z形成的最简单化合物中化学键类型相同 | |
| C. | YW能与WQ发生复分解反应 | |
| D. | 最简单气态氢化物的稳定性:X<Z |
14.下列各组物质在溶液中进行反应,可以用同一离子方程式表示的是( )
| A. | Na2CO3和HNO3;NaHCO3和HNO3 | B. | BaCl2和Na2CO3;Ba(OH)2和K2CO3 | ||
| C. | Ba(OH)2和NaHSO4;Ba(OH)2和H2SO4 | D. | NaOH和HF;Ba(OH)2和HNO3 |
12.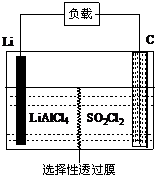 为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )
为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )
 为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )
为了国防现代化,某军事科研所研发了一种新型的Li-SO2Cl2军用电池,其组成结构示意图如图所示.已知电池总反应为:2Li+SO2Cl2═2LiCl+SO2↑.下列说法中不正确的是( )| A. | 电池的负极反应为:2Li-2e-═2Li+ | |
| B. | 工作时电流方向:锂电极→导线→负载→碳棒 | |
| C. | 正极电极反应为:SO2Cl2+2e-═2Cl-+SO2↑ | |
| D. | 电池工作时,会在碳棒表面看到气泡产生 |
 A~I为中学化学中常见的物质,B、E、F为单质,且在常温下B是一种黄绿色有毒气体,E为紫红色金属,G为黑色固体.它们的相互转化关系如图所示(部分生成物未列出).请回答下列问题:
A~I为中学化学中常见的物质,B、E、F为单质,且在常温下B是一种黄绿色有毒气体,E为紫红色金属,G为黑色固体.它们的相互转化关系如图所示(部分生成物未列出).请回答下列问题: .
.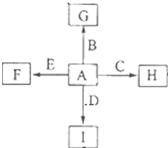 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
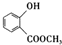
+CH3COONa+CH3OH+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式). )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).

 ;
; HClO+OH-;
HClO+OH-;