题目内容
Na2SO3固体在空气中久置容易变质.
(Ⅰ)Na2SO3固体在空气中变质的主要原因,用化学方程式表示为 .
(Ⅱ)为探究Na2SO3样品的变质情况,现提出以下假设:
假设1:Na2SO3样品完全变质;
假设2:Na2SO3样品完全没有变质;
假设3: .
补充完成以下实验过程及现象和结论,完成探究.
(Ⅲ)为测定某无水Na2SO3固体样品的纯度,甲同学设计了下图实验.
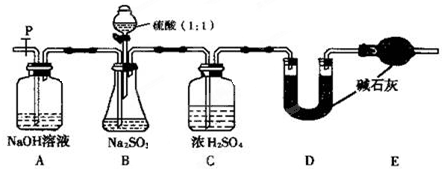
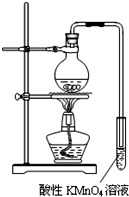
(1)检查B装置气密性的操作为 .
(2)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 .
(3)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 处(填图中字母)装置实验前后的质量差.
(Ⅰ)Na2SO3固体在空气中变质的主要原因,用化学方程式表示为
(Ⅱ)为探究Na2SO3样品的变质情况,现提出以下假设:
假设1:Na2SO3样品完全变质;
假设2:Na2SO3样品完全没有变质;
假设3:
补充完成以下实验过程及现象和结论,完成探究.
| 实验操作 | 现象和结论 |
| 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 现象:若KMnO4溶液的紫红色褪为无色 ①结论:样品中有 ②褪色的离子方程式为: |
| 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; | ③现象:若 结论:假设2成立. |
| … | … |

(1)检查B装置气密性的操作为
(2)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是
(3)除已称量的a g Na2SO3样品外,实验中还应测定的数据是
考点:性质实验方案的设计
专题:实验设计题
分析:(Ⅰ)亚硫酸钠固体被氧气氧化为硫酸钠;
(Ⅱ)①亚硫酸钠可能完全氧化,没有氧化或部分氧化三种情况;
②利用亚硫酸钠和高锰酸钾反应验证亚硫酸根离子的存在,依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在;
(Ⅲ)(1)根据密闭容器中内外压强差不同形成水柱或气泡来检查气密性;
(2)根据实验中待锥形瓶中不再产生气体后,二氧化硫会滞留在装置中影响测定的结果;
(3)根据实验的原理通过测定二氧化硫的质量来求出亚硫酸钠的质量,最后求出亚硫酸钠的质量分数.
(Ⅱ)①亚硫酸钠可能完全氧化,没有氧化或部分氧化三种情况;
②利用亚硫酸钠和高锰酸钾反应验证亚硫酸根离子的存在,依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在;
(Ⅲ)(1)根据密闭容器中内外压强差不同形成水柱或气泡来检查气密性;
(2)根据实验中待锥形瓶中不再产生气体后,二氧化硫会滞留在装置中影响测定的结果;
(3)根据实验的原理通过测定二氧化硫的质量来求出亚硫酸钠的质量,最后求出亚硫酸钠的质量分数.
解答:
解:(Ⅰ)亚硫酸钠固体被氧气氧化为硫酸钠,故反应方程式为:2Na2SO3+O2=2Na2SO4,故答案为:2Na2SO3+O2=2Na2SO4;
(Ⅱ)①亚硫酸钠可能没有氧化,完全氧化或部分氧化,故假设3为Na2SO3部分变质;
②利用亚硫酸钠和高锰酸钾反应验证亚硫酸根离子的存在,依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在;
实验操作设计为:
步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液,若KMnO4溶液的紫红色褪为无色,说明存在亚硫酸钠,亚硫酸钠把高锰酸根离子还原为二价锰离子,反应的离子方程式为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,产生无色气体,除去亚硫酸钠,再滴加适量BaCl2溶液,若无白色沉淀生成,则说明白色固体不含Na2SO4,假设2成立;
故答案为:Na2SO3部分变质;SO32-;2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;加稀HCl产生无色气体,再滴加适量BaCl2溶液,若无白色沉淀生成;
(Ⅲ)(1)根据密闭容器中内外压强差不同形成水柱或气泡来检查气密性,操作为关闭开关p和分液漏斗活塞,往C中加水至淹没导管口,微热B,C导管口有气泡冒出,停止加热一会儿后导管中形成倒吸的水柱,则气密性良好,
故答案为:关闭开关p和分液漏斗活塞,往C中加水至淹没导管口,微热B,C导管口有气泡冒出,停止加热一会儿后导管中形成倒吸的水柱,则气密性良好;
(2)实验中待锥形瓶中不再产生气体后,二氧化硫会滞留在装置中,所以通入空气使产生的二氧化硫全部进入后续的装置,
故答案为:将装置中的二氧化硫全部排入U形管中吸收;
(3)实验的原理通过测定二氧化硫的质量来求出亚硫酸钠的质量,二氧化硫的质量也就是U型管增重的质量,故答案为:D.
(Ⅱ)①亚硫酸钠可能没有氧化,完全氧化或部分氧化,故假设3为Na2SO3部分变质;
②利用亚硫酸钠和高锰酸钾反应验证亚硫酸根离子的存在,依据硫酸根离子和氯化钡溶液反应生成硫酸钡白色沉淀验证硫酸根离子的存在;
实验操作设计为:
步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液,若KMnO4溶液的紫红色褪为无色,说明存在亚硫酸钠,亚硫酸钠把高锰酸根离子还原为二价锰离子,反应的离子方程式为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;
步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,产生无色气体,除去亚硫酸钠,再滴加适量BaCl2溶液,若无白色沉淀生成,则说明白色固体不含Na2SO4,假设2成立;
故答案为:Na2SO3部分变质;SO32-;2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;加稀HCl产生无色气体,再滴加适量BaCl2溶液,若无白色沉淀生成;
(Ⅲ)(1)根据密闭容器中内外压强差不同形成水柱或气泡来检查气密性,操作为关闭开关p和分液漏斗活塞,往C中加水至淹没导管口,微热B,C导管口有气泡冒出,停止加热一会儿后导管中形成倒吸的水柱,则气密性良好,
故答案为:关闭开关p和分液漏斗活塞,往C中加水至淹没导管口,微热B,C导管口有气泡冒出,停止加热一会儿后导管中形成倒吸的水柱,则气密性良好;
(2)实验中待锥形瓶中不再产生气体后,二氧化硫会滞留在装置中,所以通入空气使产生的二氧化硫全部进入后续的装置,
故答案为:将装置中的二氧化硫全部排入U形管中吸收;
(3)实验的原理通过测定二氧化硫的质量来求出亚硫酸钠的质量,二氧化硫的质量也就是U型管增重的质量,故答案为:D.
点评:本题主要考查了亚硫酸钠样品中成分的检验和亚硫酸钠含量的测定,抓住测定的原理是解题的关键,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温下,28g Fe与足量的浓硝酸反应,转移的电子数为1.5 NA |
| B、常温常压下,4.6 g的NO2和N2O4混合物中,含原子总数为0.3NA |
| C、1.0L 1.0 mol/LNaAlO2水溶液中含有的氧原子数为2NA |
| D、11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA |
下列说法或描述中,不符合实际的是( )
| A、医用药品应在低温、干燥的环境下密封保存 |
| B、反应中的某一物质的转化率α(B)增大,则该反应的平衡常数K一定增大 |
| C、向一堆篝火“鼓风”,有助于它继续燃烧下去 |
| D、微量的MnO2粉末可以使过氧化氢快速分解,而MnO2的质量在反应前后并没发生变化 |
短周期主族元素X、Y、Z、W,原子序数依次增大.X、Z同主族,X、Y、Z三种元素主族序数之和为15,Y原子最外层电子数等于X原子最外层电子数的一半.下列叙述正确的是( )
| A、非金属性:X<Z |
| B、原子半径:X<W<Z<Y |
| C、最高价氧化物对应水化物的酸性:W<Z |
| D、单质Y常温下能溶于浓硝酸 |
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.