题目内容
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 64gCaC2中含有的共用电子对数为3NA | |
| B. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| C. | 4.6gNO2在标准状况下,含有的分子数为0.1NA | |
| D. | 50mL12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A.CaC2中C22-的电子式为 ,故1molCaC2含3mol共用电子对,64gCaC2的物质的量为$\frac{64g}{64g/mol}$=1mol,故含3mol共用电子对,即3NA电子对;
,故1molCaC2含3mol共用电子对,64gCaC2的物质的量为$\frac{64g}{64g/mol}$=1mol,故含3mol共用电子对,即3NA电子对;
B.己烷标准状况下不是气体;
C.NO2不稳定极易转化为N2O4,即2NO2?N2O4存在这样的动态平衡,故无法求其分子数;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应.
解答 解:A.CaC2中C22-的电子式为 ,故1molCaC2含3mol共用电子对,64gCaC2的物质的量为$\frac{64g}{64g/mol}$=1mol,故含3mol共用电子对,即3NA电子对,故A正确;
,故1molCaC2含3mol共用电子对,64gCaC2的物质的量为$\frac{64g}{64g/mol}$=1mol,故含3mol共用电子对,即3NA电子对,故A正确;
B.标准状况下,11.2L己烷不是气体,故B错误;
C.NO2不稳定极易转化为N2O4,即2NO2?N2O4存在这样的动态平衡,故无法求其分子数,故C错误;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故盐酸不能反应完全,则转移的电子数小于0.3NA个,故D错误,
故选A.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量与物理量之间的转化关系,明确标况下气体摩尔体积的使用条件.

练习册系列答案
相关题目
3.为了分离提纯蛋白质,不可在蛋白质溶液中加入下列试剂中的( )
| A. | 甲醛溶液 | B. | 饱和硫酸钠溶液 | C. | 硝酸铅溶液 | D. | 饱和硫酸铜溶液 |
4.下列各组离子中,能大量共存且加入(或通入)X试剂后发生反应的离子方程式对应正确的是( )
| 选项 | 离子组 | 试剂X | 离子方程式 |
| A | Fe3+、Al3+、SiO32-、NO3- | 过量的盐酸 | SiO32-+2H+=H2SiO3↓ |
| B | 透明溶液中:Fe3+、NH4+、SO42-、Cl- | 过量的铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| C | Na+、Ba+、HCO3-、Cl- | NaHSO4溶液 | H++HCO3-=CO2↑+H2O |
| D | pH=1的溶液中:Mg2+、Fe2+、NO3-、SO42- | 双氧水 | 2Fe2++H2O2+2H+=2Fe3++2H2O |
| A. | A | B. | B | C. | C | D. | D |
1.将少量高聚物M在氢氧化钠浓溶液中煮沸一段时间后,得到无色透明溶液,将溶液蒸发浓缩,冷却至室温,加入硫酸酸化,得到白色晶体N,同时剩余溶液中还含有一种有机物R,经仪器分析得出,N中含有苯环,N、R分子中均含有两种不同化学环境的氢原子.下列判断正确的是( )
| A. | R可能为乙二酸 | |
| B. | N可能为对苯二甲酸 | |
| C. | 高聚物M为加聚产物 | |
| D. | 含有羧基的物质在常温下均易溶于水 |
8.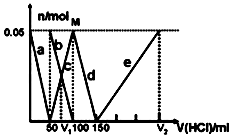 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
(已知:H2CO3的电离平衡常数K1=4.3×10-7,K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)
 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1=4.3×10-7,K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)
| A. | a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O | |
| B. | M点时生成的CO2为0.05mol | |
| C. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| D. | V1:V2=1:4 |
18. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑
(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ/mol
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-157kJ/mol
则方法a中反应的热化学方程式是:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ/mol.
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
①上述装置中B电极应连D电极(填“C”或“D”)
②该离子交换膜为阴离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为:2Cu-2e-+2OH-=Cu2O+H2O.
③原电池中负极反应式为:N2H4-4e-+4OH-=N2↑+4H2O.
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:
2H2O$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示:
①催化剂的效率:实验①<实验②(填“>”或“<”);
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:K1=K2<K3.
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑
(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ/mol
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-157kJ/mol
则方法a中反应的热化学方程式是:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ/mol.
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
①上述装置中B电极应连D电极(填“C”或“D”)
②该离子交换膜为阴离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为:2Cu-2e-+2OH-=Cu2O+H2O.
③原电池中负极反应式为:N2H4-4e-+4OH-=N2↑+4H2O.
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:
2H2O$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示:
| 号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:K1=K2<K3.
5.在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始浓度和起始容积相同,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.相关数据如表所示:下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料n | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积/L | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | v甲 | v乙 | v丙 |
| A. | V甲>V乙 | B. | K丙>K乙 | C. | V甲=V丙 | D. | c乙>c甲 |
4.赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S+2Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑.对于该反应的下列说法正确的是( )
| A. | 该反应中的氧化剂只有Cu2O | |
| B. | Cu2S在反应中既是氧化剂又是还原剂 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 生成1 mol Cu,转移2 mol电子 |