题目内容
14.下列表述中,正确的是( )| A. | 常温下,0.1mol•L-1的醋酸钠溶液中,c2(H+)=Kw-c(CH3COOH)•c(H+) | |
| B. | 常温下,各为0.1mol•L-1的NaHCO3和Na2CO3的混合溶液中:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 向氨水中滴加适量的盐酸呈酸性时,不可能有c(Cl-)>c(H+)=c(NH4+)>c(OH-) | |
| D. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A.醋酸钠溶液中存在质子守恒,氢氧根离子浓度等于溶液中氢离子浓度和醋酸浓度之和,结合离子积常数和质子守恒变式计算分析判断;
B.溶液中存在物料守恒2n(Na)=3n(C),钠离子浓度等于碳元素所有存在形式浓度之和;
C.当溶液中溶质为NH4Cl和HCl的混合溶液,可能有c(Cl-)>c(H+)=c(NH4+)>c(OH-);
D.相同浓度CH3COONa和NaClO的混合液中,常数酸性大于次氯酸,则次氯酸根离子水解程度大于醋酸根离子.
解答 解:A.常温下,0.1mol•L-1的醋酸钠溶液中存在质子守恒:c(OH-)=c(H+)+c(CH3COOH),Kw=c(OH-)•c(H+),$\frac{Kw}{c({H}^{+})}$=c(H+)+c(CH3COOH),则c2(H+)=Kw-c(CH3COOH)•c(H+),故A正确;
B.溶液中存在物料守恒2n(Na)=3n(C),钠离子浓度等于碳元素所有存在形式浓度之和,2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故B错误;
C.向氨水中滴加适量的盐酸呈酸性时,当溶液中溶质为NH4Cl和HCl的混合溶液,可能有c(Cl-)>c(H+)=c(NH4+)>c(OH-),故C错误;
D.相同浓度CH3COONa和NaClO的混合液中,常数酸性大于次氯酸,则次氯酸根离子水解程度大于醋酸根离子,溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒、物料守恒等基础知识,酸碱反应后溶液酸碱性判断,盐类水解原理是解决此类题目的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列关于铜电极的叙述中,正确的是( )
| A. | 电解稀硫酸制H2、O2时铜作阳极 | B. | 用电解法精炼粗铜时粗铜作阴极 | ||
| C. | 在镀件上电镀铜时用金属铜作阴极 | D. | 铜锌原电池中铜是正极 |
5.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O、NaOH、Na2CO3、NaCl都属于钠的含氧化合物 |
2.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA | |
| B. | NA个D2O分子中,含有10NA个电子 | |
| C. | 117克氯化钠固体中,含有2NA个氯化钠分子 | |
| D. | 32克SO2与足量的O2反应转移的电子数为NA |
9.某有机物分子式为C4H8,据此推测其结构和性质不可能的是( )
| A. | 它与乙烯可能是同系物 | |
| B. | 一氯代物只有一种 | |
| C. | 分子结构中甲基的数目可能是0、1、2 | |
| D. | 等质量的CH4和C4H8,分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
6.下列说法正确的是( )
| A. | 过量SO2通入NaOH溶液中发生SO2+2OH-═SO32-反应 | |
| B. | BF3分子中所有原子都满足最外层8电子结构 | |
| C. | 某元素原子的最外层只有2个电子,则该元素一定是ⅡA族元素 | |
| D. | 使品红溶液褪色,加热后又出现红色的实验能证明SO2气体的存在 |
3.下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液.
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
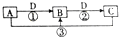 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题:
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题: