题目内容
13.某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )
Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e-═Fe+2OH-
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中.
| A. | ① | B. | ①②④ | C. | ①③④ | D. | ②③④ |
分析 ①放电时为原电池,负极发生氧化反应,正极发生还原反应;
②充电时为电解质,阴极发生还原反应;
③充电时为电解质,阳极发生氧化反应;
④Fe(OH)2、2Ni(OH)2只能存在于碱性溶液中,在酸性条件下不能存在.
解答 解:①放电时为原电池,负极发生氧化反应,正极发生还原反应,反应中Fe失去电子,为负极,Ni2O3获得电子,为正极,故①错误;
②充电时为电解质,阴极发生还原反应,Fe(OH)2在阴极获得电子,阴极上的电极反应式是Fe(OH)2+2e-═Fe+2OH-,故②正确;
③充电时为电解质,阳极发生氧化反应,Ni(OH)2发生氧化反应,为阳极,故③正确;
④Fe(OH)2、2Ni(OH)2只能存在于碱性溶液中,在酸性条件下不能存在,故电解质溶液必须是碱性溶液,故④正确,
故选:A.
点评 本题以二次电池为载体考查原电池与电解池的工作原理,注意根据总反应式从氧化还原的角度判断原电池的正负极与电解池的阴阳极.

练习册系列答案
相关题目
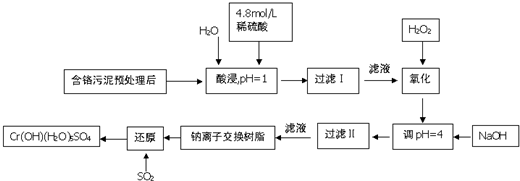
2.铬及其化合物在工业上有许多用途,但化工废料铬渣对人体健康有很大危害,以制革工也产生的含铬污泥为原料,回收污泥中三价铬的工艺流程图如图所示(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+)
:
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用时2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Al3+、Ca2+、Mg2+(填离子符号).
(5)每生成1molCr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
4.下列关于铜电极的叙述中,正确的是( )
| A. | 电解稀硫酸制H2、O2时铜作阳极 | B. | 用电解法精炼粗铜时粗铜作阴极 | ||
| C. | 在镀件上电镀铜时用金属铜作阴极 | D. | 铜锌原电池中铜是正极 |
1.能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是( )
| A. | 用Cu作阴、阳电极,电解CuCl2溶液 | |
| B. | 用Cu作阴、阳电极,电解K2SO4溶液 | |
| C. | 铜锌合金在潮湿空气中发生电化学腐蚀 | |
| D. | Cu作原电池的负极,碳棒作正极,NaCl溶液作电解质溶液 |
8.串联电路中的四个电解池分别装有0.1mol•L-1的下列溶液,用铂电极电解,连接直流电源一段时间后,溶液的pH变小的是( )
| A. | 盐酸 | B. | NaCl | C. | AgNO3 | D. | KNO3 |
5.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O、NaOH、Na2CO3、NaCl都属于钠的含氧化合物 |
2.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA | |
| B. | NA个D2O分子中,含有10NA个电子 | |
| C. | 117克氯化钠固体中,含有2NA个氯化钠分子 | |
| D. | 32克SO2与足量的O2反应转移的电子数为NA |
3.下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液.
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |