题目内容
10.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图:海藻$\stackrel{灼烧}{→}$海藻灰$\stackrel{浸泡}{→}$悬浊液$\stackrel{①}{→}$含I-的溶液$\stackrel{②}{→}$X$\stackrel{③}{→}$Y→晶态碘
某化学兴趣小组将上述流程②③设计成如图所示:
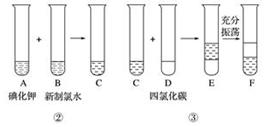
【提示:已知②中发生反应的化学方程式为Cl2+2KI═2KCl+I2】
回答下列问题:
(1)写出提取过程①③中实验操作名称:①过滤,③萃取.
根据提示,②中反应是 (填“是”或“不是”)氧化还原反应.
(2)四氯化碳本身是无色、密度比水大的液体,它不是(填“是”或“不是”)电解质.F中下层液体的颜色为紫红色,上层液体中溶质的主要成分为氯化钾(KCl).
(3)从F中将两层液体进一步分离的操作是分液.
(4)在萃取过程中,使用到的(除烧杯和铁架台外)实验仪器有C(填序号).
A.试管 B.长颈漏斗 C.分液漏斗 D.蒸发皿 E.酒精.
分析 (1)分离固体与液体混合物用过滤;碘在有机溶剂中溶解度远大于水,用萃取法从碘水中提取碘;氯水中氯气与碘离子反应生成单质碘和氯离子,依据反应中化合价是否有变化判断反应类型;
(2)依据四氯化碳是无色的、密度大于水的液体,是良好的有机溶剂,碘易溶于四氯化碳,结合电解质的概念判断;
(3)分离相互不溶的两种液体,应用分液法;
(4)萃取实验用到的仪器:烧杯和铁架台、玻璃棒、分液漏斗.
解答 解:(1)操作①前为悬浊液,后为溶液,可知为分离固体与液体的操作,即过滤;碘在有机溶剂中溶解度远大于水,用萃取法从碘水中提取碘,所以操作③为萃取;氯水中氯气与碘离子反应生成单质碘和氯离子,反应中-1价的碘升高为碘单质中的0价,有化合价升高,属于氧化还原反应;
故答案为:过滤;萃取 是;
(2)四氯化碳是无色的、密度大于水的液体,是良好的有机溶剂,碘易溶于四氯化碳,所以F中现象为:溶液分层,下层液体的颜色为紫红色,上层液体中溶质的主要成分为氯化钾(KCl),四氯化碳不溶于水,且不能电离产生自由移动的离子而导电,属于非电解质;
故答案为:无;大;不是; 紫红; 氯化钾(KCl);
(3)F中为相互不溶的两种液体,可用分液法分离;
故答案为:分液;
(4)萃取实验用到的仪器:烧杯和铁架台、玻璃棒、分液漏斗,
故选:C.
点评 本题以海水中提碘为载体考查了物质的分离与提纯,明确过滤、萃取、分液的原理是解题关键,侧重考查学生分析、解决问题的能量,注意对常见物质分离方法的积累.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
20.有关键能数据如表:
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)═SiO2(s)△H=-989.2kJ•mol-1,则表中X的值为( )
| 化学键 | Si-O | O=O | Si-Si |
| 键能kJ•mol-1 | 460 | 498.8 | X |
| A. | 423.3 | B. | 352 | C. | 920 | D. | 176 |
1.在实验中,为防止下列情况发生,采取的措施不正确的是( )
| A. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 | |
| B. | 在气体的制备实验中,若尾气污染空气,一定要用水吸收尾气 | |
| C. | 用加热KMnO4的方法制得的氧气中常带有紫色,实验中应在试管口处放一团棉花 | |
| D. | 在点燃甲烷气体前,为防止爆炸,应先验纯 |
19.下列说法中正确的是( )
| A. | HCl溶液中无OH- | |
| B. | NaOH溶液中无H+ | |
| C. | NaCl溶液中既无OH-也无H+ | |
| D. | 常温下,任何物质的水溶液中都有H+和OH-,且KW=c(H+)•c(OH-)=10-14 |
14. 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
CH3CH2CH2CH2OH$\underset{\stackrel{N{a}_{2}C{r}_{2}{O}_{7}}{→}}{{H}_{2}S{O}_{4}加热}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,简述理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)上述装置图中,D仪器的名称是直形冷凝管,E仪器的名称是锥形瓶.
(3)C1、C2温度计水银球位置不同的原因是C1控制反应温度;C2测定蒸馏出来气体的温度
(4)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化.
(5)正丁醇的同分异构体有许多种,请写出符合下列条件的正丁醇的同分异构体:①含有与正丁醇相同的官能团;②一定条件下能被氧化成醛.(CH3)2CHCH2OH
(6)本实验中正丁醛的产率为51%.
 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$\underset{\stackrel{N{a}_{2}C{r}_{2}{O}_{7}}{→}}{{H}_{2}S{O}_{4}加热}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,简述理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)上述装置图中,D仪器的名称是直形冷凝管,E仪器的名称是锥形瓶.
(3)C1、C2温度计水银球位置不同的原因是C1控制反应温度;C2测定蒸馏出来气体的温度
(4)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化.
(5)正丁醇的同分异构体有许多种,请写出符合下列条件的正丁醇的同分异构体:①含有与正丁醇相同的官能团;②一定条件下能被氧化成醛.(CH3)2CHCH2OH
(6)本实验中正丁醛的产率为51%.
 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).